题目内容
15.亚硝酸钠常用作食品防腐剂.现用如图所示仪器(夹持装置已省略)及药品.探究亚硝酸钠与硫酸的反应及生成气体产物的成分.已知气体液化的温度:NO2:21℃;NO:-152℃
回答下列问题:
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接):A→C→E→D→B.
(2)组装好仪器后,接下来进行的操作是检查装置的气密性;实验开始时通入N2的作用是防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验的干扰.
(3)关闭弹赞夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.确认A中产生的气体中含有NO,依据的现象是D中通氯气后,出现红棕色气体;装置E的作用是冷凝使NO2完全液化.
(4)根据上述实验,写出该反应的化学方程式:2NaNO2+H2SO4(浓)=Na2SO4+NO2↑+NO↑+H2O.如果没有装置C,对验证结论造成的影响是水会与NO2反应生成NO,影响后面NO的检验.
(5)实验结柬后还需通入N2的作用是把装置中的气体全部赶入到B中被吸收,以防止环境污染;如果向D中通入过量O2,则装置B中发生反应的离子方程式为4NO2+O2+4OH-=4NO3-+2H2O.
分析 硫酸与亚硝酸钠反应生成气体的成分为NO、NO2,其中NO与空气中的氧气被氧化成NO2,所以实验开始前要将装置中的空气排尽,反应前通入氮气的目的是排尽装置内的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰,根据各部分装置的作用可知,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,装置的连接为A→C→E→D→B,
(1)根据各部分装置的作用进行连接,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO;
(2)气体发生和反应装置需要装置气密性好,开始前需要检查装置气密性;赶走装置内氯气防止一些NO检验;
(3)根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断,温度低于二氧化氮液化温度时,二氧化氮变成液态;
(4)关闭弹赞夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.确认A中产生的气体中含有NO,通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成;
(5)实验结束后还需通入N2的作用是排出装置中气体吸收,防止污染空气,氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水.
解答 解:(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用检验NO,所以装置的连接为A→C→E→D→B,
故答案为:E;D;B;
(2)组装好仪器后,接下来进行的操作实验是检查装置气密性,NO很容易被氧气氧化,装置中有空气,无法检验有NO生成,所以通氮气的目的是排尽整个装置中的空气,防止产生的NO被氧化生成NO2,
故答案为:检查装置气密性;防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验的干扰;
(3)D中无色气体变成红色,说明含有NO气体,二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,
故答案为:D中通氯气后,出现红棕色气体;冷凝使NO2完全液化;
(4)通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成,所以反应方程式为:2NaNO2+H2SO4(浓)=Na2SO4+NO2↑+NO↑+H2O,如果没有装置C,二氧化氮和水反应生成一氧化氮,造成干扰,
故答案为:2NaNO2+H2SO4(浓)=Na2SO4+NO2↑+NO↑+H2O;水会与NO2反应生成NO,影响后面NO的检验;
(5)实验结束后还需通入N2的作用是排出装置中气体吸收,把装置中的气体全部赶入到B中被吸收,以防止环境污染,如果向D中通入过量O2,则装置B中发生反应的离子方程式:4NO2+O2+4OH-=4NO3-+2H2O,
故答案为:把装置中的气体全部赶入到B中被吸收,以防止环境污染;4NO2+O2+4OH-=4NO3-+2H2O.
点评 本题考查了实验方案设计、物质的检验、盖斯定律,明确物质的性质是解本题关键,根据实验现象确定物质的性质,注意仪器的连接顺序,为易错点,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 丙烯的实验式:C3H6 | B. | CO2的电子式: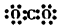 | ||
| C. | 镁离子的结构示意图: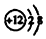 | D. | 中子数为18 的氯原子符号:1718Cl |
| A. | 131I的质量数为131 | B. | 1mol 131I的质量为131 | ||
| C. | 131I原子核外有5个电子层 | D. | 131I核外最外层电子数为7e- |

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).
| A. | 甲苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 乙酸乙酯和甘油(丙三醇) | D. | 食盐水和泥沙 |
| A. | 同一周期元素形成的简单离子的半径从左到右依次减小 | |
| B. | 主族元素的最高正价均等于其族序数 | |
| C. | 元素的非金属性、金属性与元素原子在氧化还原反应中得失电子数目的多少无关 | |
| D. | 元素的非金属性越强,其气态氢化物的还原性越弱,其气态氢化物的酸性也越弱 |
| A. | 最高价氧化物对应水化物的碱性:乙>丙 | |
| B. | 简单气态氢化物的稳定性:丁>甲 | |
| C. | 简单离子半径:乙>丙>丁 | |
| D. | 甲和乙组成的化合物只存在离子键 |
| A. | O、Na、S | B. | I、Br、Cl | C. | Al、Si、P | D. | Li、Na、K |
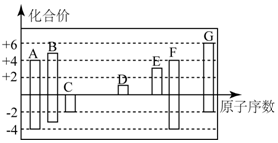 如图是部分短周期元素的常见化合价与原子序数的关系:
如图是部分短周期元素的常见化合价与原子序数的关系: ,其所含化学键类型为离子键和非极性键.
,其所含化学键类型为离子键和非极性键.