题目内容
1.食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.实验室提纯NaCl的流程如下:
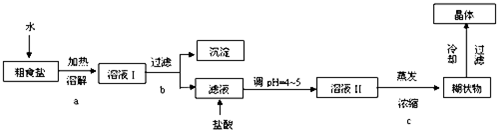
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的多种试剂,按滴加顺序依次为
i NaOH,iiBaCl2溶液,iii饱和Na2CO3溶液(填化学式).
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:Fe3++3OH-=Fe(OH)3↓,Mg2++2OH-=Mg(OH)2↓;
加入试剂iii:Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓.
(3)从NaCl溶液中得到NaCl晶体的操作步骤为蒸发结晶.
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如右:
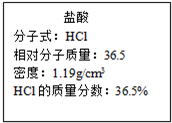
欲用上述浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶(填仪器名称)
②需量取的浓盐酸的体积为:16.8mL.
分析 (1)加入过量的氢氧化钠可以除去镁离子和三价铁离子,加入过量的氯化钡可以除去硫酸根离子,最后加入过量的碳酸钠除去过量的钡离子和钙离子,注意碳酸钠一定放在在后;
(2)加入氢氧化钠后氢氧根离子与镁离子反应生成氢氧化镁沉淀,与铁离子反应生成氢氧化铁沉淀;
加入碳酸钠后,钙离子与碳酸根离子反应生成碳酸钙沉淀,钡离子与碳酸根离子反应生成碳酸钡沉淀;
(3)氯化钠的溶解度随温度变化不大;
(4)①据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
②依据稀释前后溶液中所含的氯化氢的物质的量不变计算解答.
解答 解:(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,应首先加入过量的氢氧化钠除去镁离子和三价铁离子,然后加入过量的氯化钡可以除去硫酸根离子,最后加入过量的饱和碳酸钠溶液除去过量的钡离子和钙离子,
故答案为:BaCl2溶液;饱和Na2CO3溶液;
(2)加入氢氧化钠后氢氧根离子与镁离子反应生成氢氧化镁沉淀,离子方程式为:Fe3++3OH-=Fe(OH)3↓,
与铁离子反应生成氢氧化铁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
加入碳酸钠后,钙离子与碳酸根离子反应生成碳酸钙沉淀,离子方程式为:Ba2++CO32-=BaCO3↓;
钡离子与碳酸根离子反应生成碳酸钡沉淀,离子方程式:Ca2++CO32-=CaCO3↓;
故答案为:Fe3++3OH-=Fe(OH)3↓,Mg2++2OH-=Mg(OH)2↓;Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓;
(3)氯化钠溶解度随温度变化不大,从NaCl溶液中得到NaCl晶体的操作步骤为:蒸发结晶,
故答案为:蒸发结晶;
(4)①用浓溶液配制烯溶液的步骤为:计算出需要的浓盐酸的体积16.8ml,用20ml量筒量取所需要的浓盐酸的体积,在烧杯中稀释(可用量筒量取水),用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以还需要的玻璃仪器有:20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶;
故答案为:20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶;
②从浓盐酸试剂瓶上的有关数据可知盐酸的密度为1.19g/ml,质量分数为36.5%,摩尔质量为36.5g/mol,
依据C=$\frac{1000ρw}{M}$,该浓盐酸的物质的量浓度为:C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,稀释前后溶液中所含的氯化氢的物质的量不变,设消耗浓盐酸的体积为Vml,则11.9mol/L×V=0.400mol/L×500ml,解得V=16.8mL,
故答案为:16.8mL.
点评 本题考查了粗盐的提纯以及一定物质的量浓度溶液的配置,题目难度不大,明确除去杂质离子用到的试剂及顺序,熟悉配置一定物质的量浓度溶液所需要的仪器和步骤是解题的关键.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
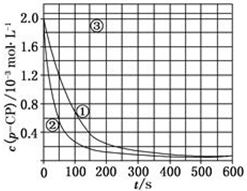 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
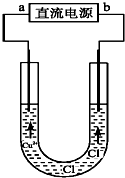
| A. | a端是直流电源的负极 | |
| B. | 阴极附近Cu2+浓度增大 | |
| C. | 阳极有铜析出 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
| A. | NaOH | B. | NaCl | C. | Na2O2 | D. | HCl |