题目内容
4.25℃时,取0.lmol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:(1)混合溶液的pH=8的原因A-+H2O?HA+OH-(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)> (选填“>”、“<”、“=”)0.1mol•L-1NaOH 溶液中由水电离出的c(H+);
(3)混合液中:c(HA)+c(A-)=0.05 mol•L-1;
(4)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的 pH>7(选填“>”、“<”、“=”);
(5)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序A>B>D>C(填字母).
A.NH4HCO3 B.NH4A C.NH4HSO4 D.NH4Cl
(6)某温度下,V1L pH=a的盐酸与V2L pH=b的NaOH溶液混合后溶液呈中性.若a+b=13,则V1:V2=1:10(溶液体积变化忽略不计).
分析 (1)盐溶液呈碱性说明该盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
(2)含有弱根离子的盐能促进水电离,酸或碱能抑制水电离;
(3)根据物料守恒分析;
(4)根据题意知,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性大于碳酸,由此得知铵根离子水解程度小于碳酸根离子;
(5)根据离子的水解程度判断溶液酸碱性的大小;
(6)混合溶液显中性,则V1×10-a=V2×10b-14,根据a+b=13计算.
解答 解:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O?HA+OH-,
故答案为:A-+H2O?HA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol•L-1NaOH溶液中由水电离出的c(H+),
故答案为:>;
(3)0.lmol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合,由物料守恒可知,c(HA)+c(A-)=0.05mol/L,
故答案为:0.05;
(4)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;
故答案为:>;
(5)NH4HCO3 显碱性;
NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性;
NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性;
NH4HSO4中硫酸氢根离子能完全电离出氢离子,溶液强显酸性;
所以pH大小顺序为A>B>D>C,
故答案为:A>B>D>C;
(6)常温下,V1L pH=a的盐酸与V2L pH=b的NaOH溶液混合后溶液呈中性,则V1×10-a=V2×10b-14,而a+b=13,则V1:V2=1:10,故答案为:1:10.
点评 本题考查了盐溶液呈酸碱性的原因、溶液酸碱性的判断、离子浓度大小的比较等知识点,题目难度中等,侧重于考查学生对基础知识的应用能力和分析能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | 建造三峡大坝使用了大量水泥,水泥属于硅酸盐材料 | |
| B. | 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 |
| A. | PCl5 | B. | BF3 | C. | CCl4 | D. | NH3 |
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
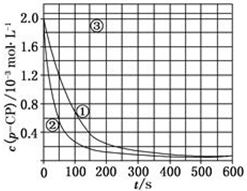 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
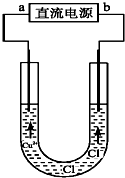
| A. | a端是直流电源的负极 | |
| B. | 阴极附近Cu2+浓度增大 | |
| C. | 阳极有铜析出 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
| A. | 充电电池可以无限制的反复充电、放电 | |
| B. | 充电电池的化学原理是氧化还原反应 | |
| C. | 较长时间不使用电器时,最好将电器中电池取出,并妥善存放 | |
| D. | 充电是放电时的氧化还原反应逆向进行 |