题目内容
19.以下是某同学测定硫酸钠晶体中结晶水含量的实验方案.实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平.
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量.重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数.
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是坩埚钳、酒精灯;
(2)指出实验步骤中存在的错误并改正:步骤②有错误,应先将试样研细,后放入坩埚称重;
(3)硫酸钠不能放置在空气中冷却的原因是因硫酸钠放置在空气中冷却时,会吸收空气中的水分;
(4)步骤⑤的目的是保证样品中的结晶水已经全部脱去;
(5)下面的情况有可能造成测试结果偏高的是BDF(填序号).
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时晶体溅出.
分析 (1)首先根据实验步骤中的各步操作,确定所需的实验仪器,将盛有试样的坩埚加热需要坩埚钳、酒精灯等,而这些仪器在试题所提供的仪器中并没有出现,因此可确定它们是所缺少的实验用品;
(2)为了保证称量准确,步骤②有错误,应先将称量的试样放入研钵中研细,再放回到坩埚中称重;
(3)本实验为定量实验,对准确性的要求较高.在加热后冷却时,为了防止硫酸钠吸水,应将硫酸钠放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸钠;
(4)将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量,重复本操作,直至两次称量结果不变,这是为了确定样品中结晶水已经被全部除去;
(5)在测定中若被测样品中含有加热易挥发的杂质或实验前坩埚未完全干燥或者加热时有硫酸钠损失,都会造成测量结果偏高.
解答 解:(1)根据实验步骤,将盛有试样的坩埚加热需要坩埚钳、酒精灯,而这些仪器在试题所提供的仪器中并没有出现,故答案为:坩埚钳、酒精灯;
(2)为了保证称量准确,步骤②有错误,应先将称量的试样放入研钵中研细,再放回到坩埚中称重,故答案为:步骤②有错误,应先将试样研细,后放入坩埚称重;
(3)在加热后冷却时,为了防止硫酸钠吸水,应将硫酸钠放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸钠,所以硫酸钠不能放置在空气中冷却的原因是因硫酸钠放置在空气中冷却时,会吸收空气中的水分;故答案为:因硫酸钠放置在空气中冷却时,会吸收空气中的水分;
(4)实验中的加热、冷却、称量的操作步骤要重复进行,直至两次称量结果不变,这是为了确定样品中结晶水已经被全部脱去,这样做是为了保证定量实验的准确性.故答案为:保证样品中的结晶水已经全部脱去;
(5)A、被测样品中含有加热不挥发的杂质会导致测定的水的质量偏小,故A错误;
B、被测样品中含有加热易挥发的杂质会导致测定结果偏大,故B正确;
C、实验前被测样品已有部分失水会导致测定的水的质量偏小,故C错误;
D、加热前所用的坩埚未完全干燥,加热后水挥发,导致水的质量测定结果偏大,故D正确;
E、晶体加热脱水不完全,会导致测定的水的质量偏小,故E错误;
F、加热时有晶体溅出,导致水的质量测定结果偏大,故F正确.
故答案为:BDF.
点评 本题考查了硫酸钠晶体中结晶水含量的测定,题目难度不大,注意掌握测定硫酸钠晶体结晶水含量的方法,明确实验过程中恒重称量的意义及硫酸钠晶体中结晶水的计算方法.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx$\frac{\underline{\;催化剂\;}}{\;}$(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如图1
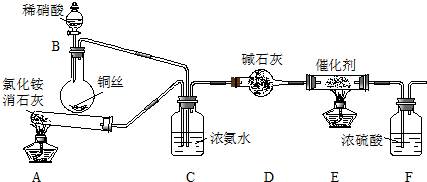
①装置A中发生反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②装置D中碱石灰的作用是除去气体中含有的水蒸气.
(2)用Na2CO3溶液吸收法处理NOx.
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3═2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3═NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是D(填字母).
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为1.875.
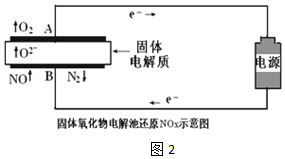
(3)用固体氧化物电解池通过电解方式分解NOx.当以Pt作电极时,固体氧化物电解池还原NO示意图如图2.
298K时,有关实验数据如下,(化学反应消耗的电能占总电能的80%)
| 实验序号 | B极气体 | 电路中通过电子 | 消耗总电能 | 生成N2 |
| 实验1 | NO | 1mol | a KJ | 0.25mol |
| 实验2 | NO和空气 (不考虑NO2) | 1mol | a KJ | 0.09mol |
①根据实验组1数据,NO分解的热化学方程式2NO(g)=N2(g)+O2(g)△H=+3.2akJ•mol-1
②实验组2明显比实验组1生成的N2少,其原因用电极反应式表示为O2+4e-=2O2-或2NO2+8e-=4O2-+N2.
| A. | 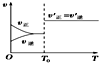 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 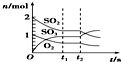 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
①在滤液中通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤.
合理的操作顺序是( )
| A. | ②⑤①③④ | B. | ①③⑤②④ | C. | ①②③④⑤ | D. | ②①③⑤④ |
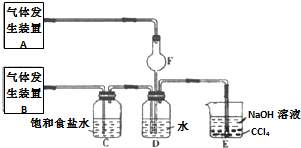
 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
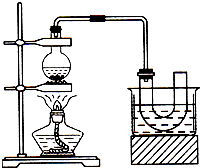
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃): 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答: 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题: