题目内容
7.如图所示与对应叙述相符合的是( )| A. | 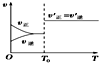 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 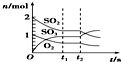 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
分析 A.升高温度后平衡一定发生移动,则正逆反应速率不会相等;
B.缩小容器容积后增大了压强,平衡向着正向移动;
C.该反应气体体积缩小的反应,达到平衡后增大压强,平衡向着正向移动,则正反应速率大于逆反应速率;
D.先拐先平温度高,据此可判断T1、T2温度大小,然后结合该反应为吸热反应及温度对化学平衡的影响判断.
解答 解:A.反应H2(g)+I2(g)?2HI(g)为发热反应,达到平衡后升高温度时,平衡向着逆向移动,则逆反应速率大于正反应速率,图示曲线变化与实际不相符,故A错误;
B.反应2SO2(g)+O2(g)?2SO3(g)为气体体积缩小的反应,该反应达到平衡后,缩小容器容积时压强增大,平衡向着正向移动,则三氧化硫的物质的量增大,二氧化硫和氧气的物质的量减小,图示曲线变化与实际相符,故B正确;
C.反应N2(g)+3H2(g)?2NH3(g)达到平衡后,增大压强平衡向着正向移动,则正反应速率应该大于逆反应速率,图示曲线变化与实际不相符,故C错误;
D.“先拐先平温度高”,则T1<T2,该反应为吸热反应,温度越高水蒸气的含量越高,则T2时水蒸气的含量更高,图示曲线与实际不相符,故D错误;
故选B.
点评 本题考查了物质的量或浓度随时间变化的曲线,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握方向化学平衡曲线的常用方法,试题侧重考查学生的分析、理解能力及灵活运用能力.

练习册系列答案
相关题目
20.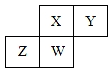 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | ZY2晶体熔化、液态Y3气化均需克服分子间作用力 |
2.肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂.
(1)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ.mol-1
则使1mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是1793kJ.
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线Ⅰ所示.

①请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线.
②800℃时,若开始时向容器中同时加入1mol/L NO、0.2mol/L O2、0.5mol/L NO2,则v(正)>v(逆)(填“>”或“<”或“=”或“无法确定”).
(3)己知N2O4(g)?2NO2(g)△H=+57.20 kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,两种物质的浓度随时间变化关系如表所示:
①该反应的平衡常数K=0.9.
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
(1)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ.mol-1
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线Ⅰ所示.

①请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线.
②800℃时,若开始时向容器中同时加入1mol/L NO、0.2mol/L O2、0.5mol/L NO2,则v(正)>v(逆)(填“>”或“<”或“=”或“无法确定”).
(3)己知N2O4(g)?2NO2(g)△H=+57.20 kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,两种物质的浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
16.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
(4)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50%C.61% D.70%

可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为

(4)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50%C.61% D.70%