题目内容
13.下列说法中正确的是( )| A. | BaSO3与H2O2的反应为氧化还原反应 | |
| B. | 因为SO2有漂白性,所以SO2可使溴水褪色 | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
分析 A.BaSO3和H2O2的反应生成硫酸钡和水;
B.SO2可使溴水褪色表现SO2有强还原性;
C.浓硫酸随反应进行浓度变稀后不与铜继续反应;
D.氯气和二氧化硫具有漂白性,氯气利用的是次氯酸的强氧化性,二氧化硫利用的是结合有色物质形成不稳定的无色物质;
解答 解:A.BaSO3和H2O2的反应生成硫酸钡和水,反应方程式为BaSO3+H2O2=BaSO4+H2O,该反应中O元素化合价由-1价变为-2价、S元素化合价由+4价变为+6价,有电子转移,属于氧化还原反应,故A正确;
B.SO2可使溴水褪色,则二氧化硫与溴单质发生氧化还原反应,体现SO2有强还原性,故B错误;
C.浓硫酸随反应进行浓度变稀后不与铜继续反应,50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目小于0.46NA,故C错误;
D.Cl2、SO2均能使品红溶液褪色,氯气和水反应生成次氯酸具有漂白性,把有色物质氧化为无色物质,二氧化硫是结合有色物质形成不稳定的无色物质,加热恢复原来的颜色,未发生氧化还原反应,故D错误;
故选:A.
点评 本题考查氧化还原反应,为高频考点,侧重考查学生分析判断能力,明确氧化还原反应本质、物质性质是解本题关键,难度不大.

练习册系列答案
相关题目
3.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
②已知反应2HI(g)?H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299kJ.
③Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.108×0.108}{078{4}^{2}}$.
上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
②已知反应2HI(g)?H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299kJ.
③Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
8.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2,则平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
18.硅芯片是各种计算机、微电子产品的核心.工业上通过以下反应将自然界的二氧化硅转化为硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,下列针对该反应的分析不正确的是( )
| A. | 属于置换反应 | B. | 碳发生了还原反应 | ||
| C. | 二氧化硅是氧化剂 | D. | 24g碳充分反应生成28g硅 |
17. 工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
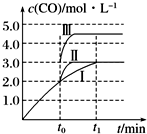
(2)在3L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2 L.
 工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(2)在3L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2 L.