题目内容
2.对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、渗析、加热分解等.下列各组混合物的分离或提纯应采用什么方法?(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒.可用过滤的方法除去Ca(OH)2溶液中悬浮的CaCO3颗粒.
(2)实验室中制取的Fe(OH)3胶体中常常含有杂质Cl-.可用渗析的方法除去Fe(OH)3胶体中混有的杂质Cl-.
分析 (1)CaCO3不溶于水,可用过滤的方法分离;
(2)胶体粒子不能透过半透膜.
解答 解:(1)CaCO3不溶于水,实验室中的石灰水久置,液面上常悬浮有CaCO3结膜,可用过滤的方法分离,故答案为:过滤;
(2)胶体粒子不能透过半透膜,可用渗析的方法除去杂质离子,故答案为:渗析.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同为解答该题的关键,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
13.下列说法中正确的是( )
| A. | BaSO3与H2O2的反应为氧化还原反应 | |
| B. | 因为SO2有漂白性,所以SO2可使溴水褪色 | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
10.只改变一个条件,则下列对图象的解读正确的是( )
| A. | 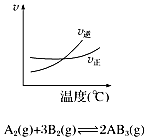 如图说明此反应的正反应是吸热反应 | |
| B. | 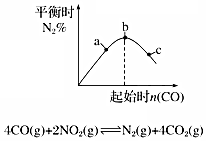 如图说明NO2的转化率b>a>c | |
| C. |  如图说明反应至15 min时,改变的条件是升高温度 | |
| D. |  如图说明生成物D一定是气体 |
14.一定温度下,向aL的密闭容器中加入2molNO2(g),发生如下反应:2NO2?2NO+O2,此反应达到平衡的标志是( )
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
5.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见表:
下列说法正确的是( )
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见表:
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 |
6.根据碳四价、氧二价、氢一价、氮三价的原则,可能成立的分子式是( )
| A. | C3H9O | B. | C7H15O | C. | C3H10 O | D. | C4H7NO |
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: