题目内容
17. 工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(2)在3L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2 L.
分析 (1)分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,结合温度变化分析判断反应焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;依据某时刻浓度商计算和平衡常数比较判断反应进行的方向;
(2)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变.
解答 解:(1)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,在500℃、2L的密闭容器中,进行反应③,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Q=$\frac{0.15×0.3}{0.1×0.{8}^{3}}$=0.87<K=2.5,反应正向进行,V正>V逆,
故答案为:K1•K2;>;
(2)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变的,是恒压容器,说明改变的是加入了催化剂;
当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件当曲线Ⅰ变为曲线Ⅲ时,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L.
点评 本题考查了化学平衡影响因素分析判断,平衡常数计算和影响条件的应用,题目综合性较大.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | BaSO3与H2O2的反应为氧化还原反应 | |
| B. | 因为SO2有漂白性,所以SO2可使溴水褪色 | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见表:
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 |
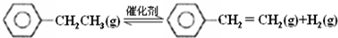
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})v}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.
图1是指:在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图.请回答:
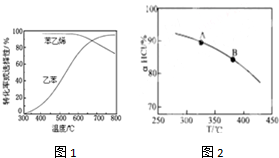
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大
(4)乙苯催化脱氢制苯乙烯,另一产物氢气可用于工业制HCl.而O2将HCl转化为Cl2,2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g)△H<0.新型RuO2催化剂对上述HCl转化为Cl2的反应具有更好的催化活性,图1是实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl-T曲线.
①A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,请在图2画出相应αHCl-T曲线的示意图.
③下列措施中有利于提高αHCl的有BD.
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O.
| A. | 配制100mL该溶液需用5.85g NaCl | |
| B. | 该溶液的物质的量浓度为1mol•L -1 | |
| C. | 该溶液中含有58.5g NaCl | |
| D. | 量取100mL该溶液,其中Na+的物质的量为0.1mol |
| A. | C3H9O | B. | C7H15O | C. | C3H10 O | D. | C4H7NO |