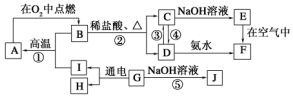
题目内容
2.VLAl2(SO4)溶液中含Al3+amol,溶液的物质的量浓度为$\frac{0.5a}{V}$mol/L,取出$\frac{V}{2}$L再加入水稀释到4VL.则稀释后溶液中SO42-的物质的量浓度是$\frac{3a}{16V}$mol/L.分析 依据1mol硫酸铝电离产生2mol铝离子、3mol硫酸根离子,结合物质的量浓度、溶液稀释过程中溶质的物质的量不变计算解答.
解答 解:1mol硫酸铝电离产生2mol铝离子、3mol硫酸根离子,则VLAl2(SO4)溶液中含Al3+amol,硫酸铝的物质的量为:0.5amol,硫酸根离子的物质的1.5amol,则硫酸铝的物质的量浓度C=$\frac{0.5a}{V}$mol/L;取出$\frac{V}{2}$L再加入水稀释到4VL,含有硫酸根离子的物质的量为:1.5a×0.5=0.75amol,稀释后硫酸根离子的物质的量浓度为:$\frac{0.75a}{4V}$=$\frac{3a}{16V}$mol/L;
故答案为:$\frac{0.5a}{V}$mol/L;$\frac{3a}{16V}$mol/L.
点评 本题考查了物质的量浓度有关计算,明确物质的量浓度概念,熟悉稀释过程中溶质的物质的量不变是解题关键,题目难度不大.

练习册系列答案
相关题目
13.0.1mol/L NH4Cl溶液中,下列叙述错误的是( )
| A. | c(NH4+)>c(Cl-)>c(OH- )>c( H+ ) | B. | c(Cl-)>c(NH4+)>c( H+ )>c(OH-) | ||
| C. | c(NH4+)+c( H+ )=c(Cl-)+c(OH- ) | D. | c(NH4+)+c( NH3•H2O )=c(Cl-) |
10.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
| A. | 用冰水混合物冷却SO3气体;加热I2 | |
| B. | 木炭吸附NO2气体;将Cl2通入品红溶液中 | |
| C. | 打开盛有NO的集气瓶;冷却NO2气体 | |
| D. | 向品红溶液中通入SO2,向FeCl3溶液滴加KSCN溶液 |
17.下列离子方程式表达正确的是( )
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O+2OH-═2AlO2-+H2O |
7.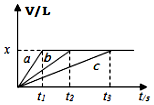 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
 ,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
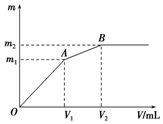 向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.
向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.