题目内容
7.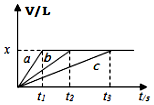 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
分析 由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数应该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,由此分析.
解答 解:A:由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,
A.由于酸不足,所以生成氢气的量为:n(H2)=$\frac{1}{2}$n(HCl)=$\frac{0.2×1}{2}$=0.1mol,所以标况下的体积为2.24L,故A错误;
B.依据分析可知,盐酸不足,镁铝剩余,故B正确;
C.依据分析,盐酸全部反应,生成氢气的物质的量为$\frac{0.2L×1mol/L}{2}$=0.1mol,生成0.1mol氢气,需要钠的物质的量为0.2mol,所以钠的物质的量不可能为0.1mol,故C错误;
D.按照金属活动性顺序,Na>Mg>Al,钠最最活泼用的时间最短,故曲条线a是钠与盐酸反应的图象,故D错误;
故选:B.
点评 本题考查钠的性质,注意钠和水反应的特点,根据物质的量的大小可与酸、水反应的特点比较生成氢气的多少,难度不大.

练习册系列答案
相关题目
19.有关如下反应的叙述正确的是( )
Ⅰ:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ/mol
Ⅳ:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=akJ/mol.
Ⅰ:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ/mol
Ⅳ:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=akJ/mol.
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |
15.下列叙述正确的是( )
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 离子键是阴、阳离子之间的吸引力 | |
| C. | 离子化合物可以含共价键 | |
| D. | 分子间作用力越大,分子越稳定 |
12. 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:
I、700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
(1)该反应的平衡常数表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; 反应在0-t1 min内的平均速率为v(H2)=$\frac{0.3}{{t}_{1}}$mol/(L.min)
(2)保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.3mol/L
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母):
a.压强不随时间改变 b.密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
II、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g)
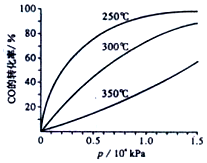
CO在不同温度下平衡转化率与压强的关系如图所示,该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强而不选择更高压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
III、某温度下,将1mol CO和1mol H2O(g)充入某固定容积的反应容器中,一段时间后达到平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),此时有$\frac{2}{3}$的CO转化为CO2.
(1)达平衡时H2O(g)的转化率是66.7%
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则开始时的速率
v(正)<v(逆)(填“>”、“<”或“=”)
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:I、700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | n[CO(g)]mol | n[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | 0.3 |
(2)保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.3mol/L
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母):
a.压强不随时间改变 b.密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
II、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g)
CO在不同温度下平衡转化率与压强的关系如图所示,该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强而不选择更高压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
III、某温度下,将1mol CO和1mol H2O(g)充入某固定容积的反应容器中,一段时间后达到平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),此时有$\frac{2}{3}$的CO转化为CO2.
(1)达平衡时H2O(g)的转化率是66.7%
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则开始时的速率
v(正)<v(逆)(填“>”、“<”或“=”)
19. 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理是环境工作者面临的挑战.试回答以下问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160KJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574KJ/mol
则由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4,
NO2-的水解常数Kh=8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25°C(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol.
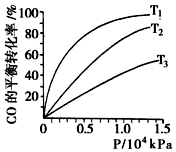
不同温度下,CO的平衡转化率如图所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为10L的恒容密闭容器中发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g).
该反应的正反应放热为反应(填“放热”、“吸热”),若起始时向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向正方向进行(填“正”、“逆”).
 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理是环境工作者面临的挑战.试回答以下问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160KJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574KJ/mol
则由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4,
NO2-的水解常数Kh=8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25°C(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol.
不同温度下,CO的平衡转化率如图所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为10L的恒容密闭容器中发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g).
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
 按要求完成下列各题:
按要求完成下列各题: