题目内容
10.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )| A. | 用冰水混合物冷却SO3气体;加热I2 | |
| B. | 木炭吸附NO2气体;将Cl2通入品红溶液中 | |
| C. | 打开盛有NO的集气瓶;冷却NO2气体 | |
| D. | 向品红溶液中通入SO2,向FeCl3溶液滴加KSCN溶液 |
分析 A、气体冷却为物理变化,碘加热升华为物理变化;
B、木炭吸附为物理变化,氯气使品红褪色属于次氯酸的性质,存在化学变化;
C、NO与空气中的氧气反应属于化学变化,气体的冷却属于物理变化;
D、二氧化硫和品红溶液反应生成无色物质属于化学变化,铁离子的验证属于化学变化.
解答 解:A.用冰水混合物冷却SO3气体,是物理变化,没有颜色变化;加热碘单质升华,为物理变化,没有颜色变化,故A错误;
B.木炭吸附NO2气体,颜色变浅,属于物理变化;将氯气通入品红溶液中,次氯酸具有漂白性,发生氧化还原反应,使品红褪色,属于化学变化,故B正确;
C.打开盛装NO的集气瓶,NO被氧化为NO2,发生的是化学反应,不是物理变化,故C错误;
D.向品红溶液中通入SO2,二氧化硫和品红溶液反应生成无色物质属于化学变化,向FeCl3溶液滴加KSCN溶液,三价铁与硫氰根离子络合生成血红色络合物,属于化学变化,故D错误;
故选B.
点评 本题考查了物理变化与化学变化的判断,明确有没有新物质的生成是物理变化与化学变化的本质区别是解题关键,题目难度中等.

练习册系列答案
相关题目
2.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如图:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
下列说法正确的是( )

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | -97.8 | 易溶于水 |
| 3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
| A. | 分离出甲醇的操作是结晶 | |
| B. | 间苯三酚与苯酚互为同系物 | |
| C. | 上述合成反应属于取代反应 | |
| D. | 洗涤时可以用饱和Na2CO3溶液除氯化氢 |
1.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如图一.
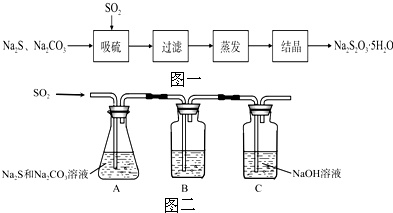
(1)吸硫装置如图二所示.
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积或控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL.则c(Na2S2O3)=$\frac{6000a}{214V}$mol•L-1.(只列出算式,不作运算)
已知:IO3-+5I-+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能偏高(填“无影响”、“偏低”或“偏高”),原因是4I-+4H++O2═2I2+2H2O.

(1)吸硫装置如图二所示.
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积或控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
已知:IO3-+5I-+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能偏高(填“无影响”、“偏低”或“偏高”),原因是4I-+4H++O2═2I2+2H2O.
5.某实验小组拟配制0.10mol•L-1的NaOH溶液并进行有关性质实验,回答下列问题.
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0 g.
(2)从表中选择称量NaOH固体所需要的仪器:abe(填序号).
(3)下列情况会使所配溶液浓度偏低的是①③⑤⑦(填序号).
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0 g.
(2)从表中选择称量NaOH固体所需要的仪器:abe(填序号).
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
15.下列叙述正确的是( )
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 离子键是阴、阳离子之间的吸引力 | |
| C. | 离子化合物可以含共价键 | |
| D. | 分子间作用力越大,分子越稳定 |
19. 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理是环境工作者面临的挑战.试回答以下问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160KJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574KJ/mol
则由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4,
NO2-的水解常数Kh=8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25°C(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol.
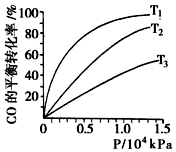
不同温度下,CO的平衡转化率如图所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为10L的恒容密闭容器中发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g).
该反应的正反应放热为反应(填“放热”、“吸热”),若起始时向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向正方向进行(填“正”、“逆”).
 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理是环境工作者面临的挑战.试回答以下问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160KJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574KJ/mol
则由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4,
NO2-的水解常数Kh=8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25°C(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol.
不同温度下,CO的平衡转化率如图所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为10L的恒容密闭容器中发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g).
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
20.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中滴入少量盐酸,然后滴入少量的氯化钡溶液 | 先无明显现象,后有白色沉淀. | 说明原溶液中含有SO42- |
| B | 向某氯化亚铁溶液中滴入少量氯水,然后滴入少量的KSCN溶液 | 溶液变成血红色 | 说明原氯化亚铁已氧化变质 |
| C | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液 | 实验开始立即产生白色沉淀 | X可能是NaHCO3 |
| D | 向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |