题目内容
14.含有O22-的物质通常接有较强的氧化化性,一定条件下也可表现出还原性等,在现代工业及生活中有着重要的用途.(1)过氧化钙可用作鱼苗长途运输中的供氧剂、消毒剂,写出过氧化钙的电子式:
 ,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.(2)过氧化氢能氧化许多物质,也能被多种常见物质能化分解.
①向20mL0.05mol•L-1的H2O2溶液中缓慢通入标准状况下22.4mLSO2(忽略溶液体积的变化),充分反应后再加入几滴甲基橙试剂,溶液变红,则反应后溶液的pH为1.
②为证明MnO2能催化H2O2的分解,同学甲设计了如图所示的装置进行实验:

但乙同学认为,仅凭此实验不能确认MnO2是该反应的催化剂,他作出此判断的理由可能是若要确定二氧化锰是催化剂,还需要确定加入的二氧化锰在反应前后质量不变、性质不变.
③FeCI3可催化H2O2的分解,其催化机理分为两个阶段,相应反应的化学方程式可表示为:
(i)2FeCl3+H2O2═2FeCl2+O2↑+2HCl、(ii)2FeCl2+H2O2+2HCl═2FeCl3+2H2O.
若在实验中加入几滴K3[Fe(CN)6]溶液,则能证明反应过程中确有Fe2+生成.
(3)过硫酸钠(Na2S2O8,有一个过氧根)其有强氧化性,Na2S2O8中硫元素的化合价为+6,向Na2S2O8溶液中加入MnSO4后可得到紫色溶液,则此反应中氧化剂与氧化产物的物质的量之比为5:2.
分析 (1)过氧化钙中钙离子与过氧根离子;过氧化钙与水反应与过氧化钠与水反应相似,生成氢氧化钙与氧气;
(2)①加入几滴甲基橙试剂,溶液变红,说明生成了酸,所以反应的方程式为:SO2+H2O2=H2SO4,结合反应方程求氢离子的物质的量浓度,然后求出溶液的PH;
②催化剂在的反应前后质量不变,参与化学反应的速率,由此分析解答;
③催化剂参与反应过程并在最后被还原出来,故第二个反应为另一部分过氧化氢将氯化亚铁氧化成氯化铁,反应的化学方程式为:2FeCl2+H2O2+2HCl═2FeCl3+2H2O,可用K3[Fe(CN)6]来检验反应过程中的亚铁离子;
(3)根据化合物中化合价代数和为0,Na2S2O8中硫元素的化合价为(2×6+1×2-2×1)×$\frac{1}{2}$=6,由题意可知,锰离子氧化成高锰酸根离子,S2O82-中过氧根被还原为-2价氧后,S2O82-会转化为硫酸根,反应中Na2S2O8是氧化剂,1molNa2S2O8可得到2mol的电子,高锰酸根离子是氧化产物,生成1mol的高锰酸根离子时得到5mol的电子,故氧化剂与氧化产物的物质的量之比为5:2.
解答 解:(1)过氧化钙(CaO2)为离子化合物,其电子式为: ,过氧化钙与水反应与过氧化钠与水反应相似,生成氢氧化钙与氧气,反应的化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑,故答案为:
,过氧化钙与水反应与过氧化钠与水反应相似,生成氢氧化钙与氧气,反应的化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑,故答案为: ;2CaO2+2H2O=2Ca(OH)2+O2↑;
;2CaO2+2H2O=2Ca(OH)2+O2↑;
(2)①加入几滴甲基橙试剂,溶液变红,说明生成了酸,所以反应的方程式为:SO2+H2O2=H2SO4,20mL0.05mol•L-1的H2O2的物质的量为:10-3mol,中缓慢通入标准状况下22.4mLSO2的物质的量为:10-3mol,所以生成硫酸的物质的量为:10-3mol,物质的量浓度为:$\frac{1{0}^{-3}}{20×1{0}^{-3}}$=0.05mol/L,则氢离子的浓度为0.1mol/L,即PH=1,故答案为:1;
②催化剂在的反应前后质量不变,参与化学反应的速率,而本实验只能说明双氧水中加入二氧化锰后有氧气生成,若要确定二氧化锰是催化剂,还需要确定加入的二氧化锰在反应前后质量不变、性质不变,故答案为:若要确定二氧化锰是催化剂,还需要确定加入的二氧化锰在反应前后质量不变、性质不变;
③催化剂参与反应过程并在最后被还原出来,故第二个反应为另一部分过氧化氢将氯化亚铁氧化成氯化铁,反应的化学方程式为:2FeCl2+H2O2+2HCl═2FeCl3+2H2O,可用K3[Fe(CN)6]来检验反应过程中的亚铁离子的存在,故答案为:2FeCl2+H2O2+2HCl═2FeCl3+2H2O;K3[Fe(CN)6]溶液;
(3)根据化合物中化合价代数和为0,Na2S2O8中硫元素的化合价为(2×6+1×2-2×1)×$\frac{1}{2}$=6,由题意可知,锰离子氧化成高锰酸根离子,S2O82-中过氧根被还原为-2价氧后,S2O82-会转化为硫酸根,反应中Na2S2O8是氧化剂,1molNa2S2O8可得到2mol的电子,高锰酸根离子是氧化产物,生成1mol的高锰酸根离子时得到5mol的电子,故氧化剂与氧化产物的物质的量之比为5:2,故答案为:6;5:2.
点评 本题考查氧化还原反应的相关知识,学生要学会分析氧化还原反应中化合的变化和相关概念的分析判断,比较容易.

| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | -97.8 | 易溶于水 |
| 3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
| A. | 分离出甲醇的操作是结晶 | |
| B. | 间苯三酚与苯酚互为同系物 | |
| C. | 上述合成反应属于取代反应 | |
| D. | 洗涤时可以用饱和Na2CO3溶液除氯化氢 |
 我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )
我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )| A. | 放电时,Na+由钠箔端向多壁碳纳米管端移动 | |
| B. | 放电时,正极的电极反应为:3CO2+4Na++4e-═2Na2CO3+C | |
| C. | 该电池不宜在高温下使用 | |
| D. | 充电时,钠箔与外接电源的正极相连 |
Ⅰ:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ/mol
Ⅳ:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=akJ/mol.
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |
| A. | 上述转化属于分解反应 | B. | 上述反应过程放出大量热 | ||
| C. | 生成的CaO可作氯气的干燥剂 | D. | CaCO3水泥的主要成分之一. |
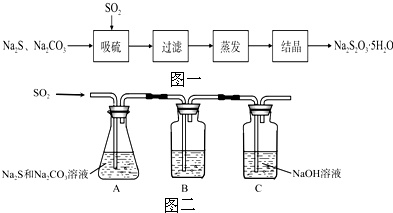
(1)吸硫装置如图二所示.
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积或控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
已知:IO3-+5I-+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能偏高(填“无影响”、“偏低”或“偏高”),原因是4I-+4H++O2═2I2+2H2O.