题目内容
14.向100mL18mol•L-1浓硫酸中加入20g铜粉,加热一段时间后,冷却,过滤,得剩余固体7.2g.(1)标准状况下,产生气体的体积是多少?(假设产生的气体全部放出)
(2)将最终所得溶液稀释至1L,滴加2mol•L-1的氢氧化钠溶液,若要使溶液中的Cu2+全部沉淀,需加入该氢氧化钠溶液的体积为1.6L.
分析 (1)反应消耗Cu的质量为:20g-7.2g=12.8g,根据反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O计算出生成二氧化硫气体的体积;
(2)铜离子全部沉淀时,反应后溶质为硫酸钠,根据S、Na元素守恒计算出需要氢氧化钠的物质的量,然后根据V=$\frac{n}{c}$计算出需要加入氢氧化钠溶液的体积.
解答 解:(1)反应消耗Cu的质量为:20g-7.2g=12.8g,则
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
64g 22.4L
12.8g V(SO2)
V(SO2)=$\frac{22.4L×12.8g}{64g}$=4.48L,
答:标准状况下,产生气体的体积为4.48L;
(2)标况下4.48L二氧化硫的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,100mL18mol•L-1浓硫酸中含有硫酸的物质的量为:18g/mol×0.1L=1.8mol,反应后溶液中含有硫酸根离子的物质的量为:1.8mol-0.2mol=1.6mol,
使溶液中的Cu2+全部沉淀时,反应后溶质为Na2SO4,根据Na元素守恒可知消耗NaOH的物质的量为:n(NaOH)=2n(Na2SO4)=1.6mol×2=3.2mol,
需加入该氢氧化钠溶液的体积为:$\frac{3.2mol}{2mol/L}$=1.6L,
故答案为:1.6.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 高效智能课时作业系列答案
高效智能课时作业系列答案| A. | 上述转化属于分解反应 | B. | 上述反应过程放出大量热 | ||
| C. | 生成的CaO可作氯气的干燥剂 | D. | CaCO3水泥的主要成分之一. |
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0 g.
(2)从表中选择称量NaOH固体所需要的仪器:abe(填序号).
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理是环境工作者面临的挑战.试回答以下问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160KJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574KJ/mol
则由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4,
NO2-的水解常数Kh=8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25°C(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol.
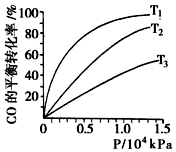
不同温度下,CO的平衡转化率如图所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为10L的恒容密闭容器中发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g).
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
| A. | 用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从上口倒出 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| C. | 可以用酒精萃取碘水中的碘 | |
| D. | 海水通过蒸馏可制得淡水 |