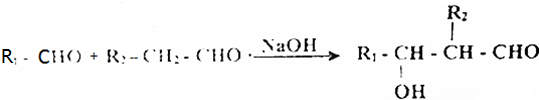题目内容
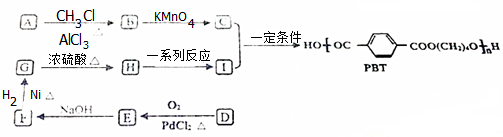
19.有机物F是一种重要的医药中间体,以化合物A(相对分子质量为126.5)为原料合成F的工艺流程如下:
已知:R-Cl$→_{C_{2}H_{5}OH}^{CH_{2}(COOC_{2}H_{5})_{2}}$RCH(COOC2H5)2$\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$RCH2COOH
(1)A的名称为3-甲基氯苯,C分子中含氧官能团的名称为酯基,反应E→F的反应类型为取代反应.
(2)对B进行核磁共振氢谱分析时,其吸收峰为5,吸收峰面积之比为1:1:1:1:2,1molB在一定条件下最多能与3molNaOH反应.
(3)已知D与SOCl2反应除生成E外还有两种易溶于水的气体生成,反应的化学方程式为
 .
.(4)满足下列条件的有机物D的同分异构体有6种.
①属于1,3,5-三取代苯; ②能发生银镜反应; ③能与氯化铁溶液显紫色
(5)根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备
 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下:
 .
.
分析 化合物A(相对分子质量为126.5)系列转化得到C,由C的结构可知A为
 ,C发生信息中反应生成D为
,C发生信息中反应生成D为 ,D中羧基中-OH被氯原子取代生成E,E发生取代反应生成F,同时还生成HCl.(6)中乙烯与氯气发生加成反应生成1,2-二氯乙烷,再与CH2(COOC2H5)2反应得到(C2H5OOC)2CHCH2CH2CH(COOC2H5)2,水解得到HOOCCH2CH2CH2CH2COOH,最后与甲醇发生酯化反应.(5)F先与氢气发生加成反应,将羰基转化为醇羟基,再发生消去反应形成碳碳双键,然后以HCl发生加成反应生成
,D中羧基中-OH被氯原子取代生成E,E发生取代反应生成F,同时还生成HCl.(6)中乙烯与氯气发生加成反应生成1,2-二氯乙烷,再与CH2(COOC2H5)2反应得到(C2H5OOC)2CHCH2CH2CH(COOC2H5)2,水解得到HOOCCH2CH2CH2CH2COOH,最后与甲醇发生酯化反应.(5)F先与氢气发生加成反应,将羰基转化为醇羟基,再发生消去反应形成碳碳双键,然后以HCl发生加成反应生成 ,再与CH2(COOC2H5)2反应得到
,再与CH2(COOC2H5)2反应得到 ,最后水解得到
,最后水解得到 .
.
解答 解:化合物A(相对分子质量为126.5)系列转化得到C,由C的结构可知A为
 ,C发生信息中反应生成D为
,C发生信息中反应生成D为 ,D中羧基中-OH被氯原子取代生成E,E分子取代反应生成F,同时还生成HCl.
,D中羧基中-OH被氯原子取代生成E,E分子取代反应生成F,同时还生成HCl.
(1)A的结构简式为:
故答案为:3-甲基氯苯;酯基;取代反应;
(2)B为 ,核磁共振氢谱分析时,其吸收峰为5,吸收峰面积之比为1:1:1:1:2,B水解得到酚羟基、醇羟基与HCl,1molB在一定条件下最多能与3molNaOH反应,
,核磁共振氢谱分析时,其吸收峰为5,吸收峰面积之比为1:1:1:1:2,B水解得到酚羟基、醇羟基与HCl,1molB在一定条件下最多能与3molNaOH反应,
故答案为:5;1:1:1:1:2;3;
(3)已知D与SOCl2反应除生成E外还有两种易溶于水的气体生成,反应的化学方程式为: ,
,
故答案为: ;
;
(4)满足下列条件的有机物D( )的同分异构体:①属于1,3,5-三取代苯; ②能发生银镜反应,说明含有醛基,③能与氯化铁溶液显紫色,含有酚羟基,其中一个取代基为-OH,另外2个取代基为-Cl、-CH2CH2CHO,或者-Cl、-CH(CH3)CHO,或者-CH2Cl、-CH2CHO,或者-CH2CH2Cl、-CHO,或者-CHClCH3、-CHO,或者-CH3、-CHClCHO,故共有6种,
)的同分异构体:①属于1,3,5-三取代苯; ②能发生银镜反应,说明含有醛基,③能与氯化铁溶液显紫色,含有酚羟基,其中一个取代基为-OH,另外2个取代基为-Cl、-CH2CH2CHO,或者-Cl、-CH(CH3)CHO,或者-CH2Cl、-CH2CHO,或者-CH2CH2Cl、-CHO,或者-CHClCH3、-CHO,或者-CH3、-CHClCHO,故共有6种,
故答案为:6;
(5)F先与氢气发生加成反应,将羰基转化为醇羟基,再发生消去反应形成碳碳双键,然后以HCl发生加成反应生成 ,再与CH2(COOC2H5)2反应得到
,再与CH2(COOC2H5)2反应得到 ,最后水解得到
,最后水解得到 ,合成路线流程图为:
,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用有机物的结构进行分析,侧重考查学生分析推理能力、知识迁移运用能力,是对有机化学基础的综合考查.

| A. | 碳酸氢钠溶液呈碱性:NaHCO3═Na++HCO3- | |
| B. | 试管上的银镜用稀硝酸洗涤:Ag+2H+═2 Ag++H2↑ | |
| C. | 澄清苯酚钠溶液中通入二氧化碳气体,出现浑浊: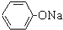 +H2O+CO2→ +H2O+CO2→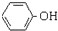 +NaHCO3 +NaHCO3 | |
| D. | 氨水与少量SO2反应:NH3?H2O+SO2═NH4++HSO3- |
 25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 曲线Ⅰ:滴加溶液到10 mL时:2 c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液>20 mL时一定符合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 滴加过程中,当pH=7时滴加的两种溶液体积都在10-20 mL之间,但不相等 |
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)-c(OH-)=c(HCO3-)+2c(CO32-) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | 25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则 c(Na+)-c(CH3COO-)=9.9×10-7mol/L | |
| D. | 25℃时,0.1mol/L的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
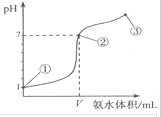 常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )
常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )| A. | 用0.1mol/LNa0H溶液代替氨水滴定盐酸达到点②时所消耗的Na0H的体积也是VmL | |
| B. | 从开始滴定后的任意一点:溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 从点①到点③的滴定过程中:水的电离程度都增大 | |
| D. | 在点②所示溶液中:c(Cl-)=c(NH4+)>c(H+),且V=20 |
| A. | 苯与液溴在FeBr3的催化作用下,发生取代反应 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 葡萄糖、蔗糖、淀粉在催化剂作用下,均可以发生水解反应 |


 .
. .
. ;F
;F .
.