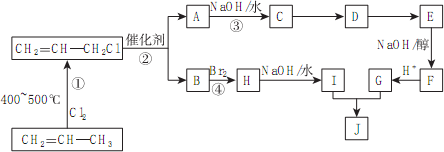
题目内容
12.以下说法正确的是( )| A. | 苯与液溴在FeBr3的催化作用下,发生取代反应 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 葡萄糖、蔗糖、淀粉在催化剂作用下,均可以发生水解反应 |
分析 A.苯与液溴发生取代反应生成溴苯;
B.二氧化硫有毒;
C.化石能源为不可再生能源;
D.葡萄糖为单糖,不能水解.
解答 解:A.苯与液溴发生取代反应生成溴苯,反应类型为取代反应,故A正确;
B.二氧化硫有毒,不能大量在食品中使用,故B错误;
C.化石能源为不可再生能源,应大力开发新能源,故C错误;
D.葡萄糖为单糖,不能水解,而蔗糖、淀粉在催化剂作用下,均可以发生水解反应,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质、反应类型及化学与生活等为解答的关键,侧重分析与应用能力的考查,注意化学与生活的密切联系,题目难度不大.

练习册系列答案
相关题目
3.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制100mL 0.1000mol/LNaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
(1)准确量取20.00mL待测盐酸放入锥形瓶,可选用的仪器有AD
A、移液管 B、量筒 C、碱式滴定管 D、酸式滴定管
(2)滴定达到终点的现象最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色;
(3)根据上述数据,可计算出该盐酸的浓度为0.1000mol/L.
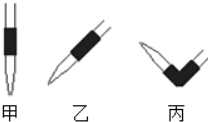
(4)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有ADEF(多选扣分):
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.称量前NaOH固体中混有Na2CO3固体.
步骤一:配制100mL 0.1000mol/LNaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.50 | 20.40 |
| 第二次 | 20.00 | 1.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.10 |
A、移液管 B、量筒 C、碱式滴定管 D、酸式滴定管
(2)滴定达到终点的现象最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色;
(3)根据上述数据,可计算出该盐酸的浓度为0.1000mol/L.
(4)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.

(5)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有ADEF(多选扣分):
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.称量前NaOH固体中混有Na2CO3固体.
20.下列物质中无Cl-的是( )
| A. | KCl溶液 | B. | KClO3 | C. | NaCl晶体 | D. | 氯水 |
4.神舟十号飞船,神舟飞船的统一双组元,推进系统采用肼作为燃料,简化了增压系统的设计,工作更为可靠. 肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液,总反应式为N 2H4+O2═N2+2H2O,下列说法中,错误的是( )
| A. | 该电池放电时,通入肼的一极为负极 | |
| B. | 电池每释放1molN2转移的电子数为4NA | |
| C. | 电池工作一段时间后,电解质溶液的pH将不变 | |
| D. | 通入空气的一极的电极反应式是:O2+2H2O+4e-=4OH- |
1.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
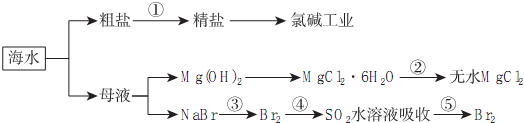

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程④中SO2被氧化 | |
| C. | 从第③步到第⑤步的目的是为了浓缩 | |
| D. | 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
2. 常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )
常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )
 常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )
常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )| A. | ②点混合溶液中水电离出的c(H+)大于酸HA溶液中由水电离出的c(H+) | |
| B. | ③点混合溶液中各离子浓度的大小关系是c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | 酸HA溶液的浓度为0.1 mol•L-1 | |
| D. | ④点溶液中,存在c(HA)+c(H+)>c(M+)+c(OH-) |
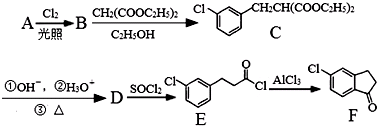
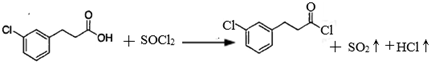 .
.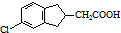 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: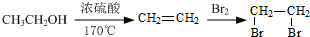
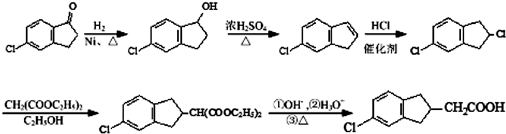 .
.
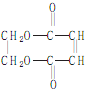 )的合成路线如下图:
)的合成路线如下图: