题目内容
7.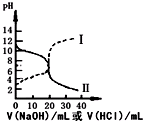 25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 曲线Ⅰ:滴加溶液到10 mL时:2 c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液>20 mL时一定符合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 滴加过程中,当pH=7时滴加的两种溶液体积都在10-20 mL之间,但不相等 |
分析 曲线I开始时pH>7,滴定过程中pH减小,是用氢氧化钠滴定醋酸,曲线Ⅱ开始时pH<7,滴定过程中pH增大,是用盐酸滴定氨水.
A.曲线I是用氢氧化钠滴定醋酸;
B.曲线Ⅰ是用氢氧化钠滴定醋酸,滴加溶液到10 mL时:得到的是醋酸和醋酸钠的混合物;
C.曲线Ⅱ是用盐酸滴定氨水,滴加溶液>20 mL时,得到的是氯化铵和氨水的混合物;
D.滴加过程中,当pH=7时溶液显中性,结合微粒守恒、电荷守恒判断.
解答 解:曲线I开始时pH>7,滴定过程中pH减小,是用盐酸滴定氨水,曲线Ⅱ开始时pH<7,滴定过程中pH增大,是用氢氧化钠滴定醋酸.
A.曲线I是用氢氧化钠滴定醋酸,故A错误;
B.曲线Ⅰ是用氢氧化钠滴定醋酸,滴加溶液到10 mL时:得到的是等浓度的醋酸钠和醋酸的混合物,存在电荷守恒:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),整理两个式子得到:2 c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-),故B正确;
C.曲线Ⅱ是用盐酸滴定氨水,滴加溶液>20 mL时,得到的是氯化铵和氨水的混合物,显示碱性,故C错误;
D.滴加过程中,当pH=7时溶液显中性,醋酸钠和氯化铵溶液分别是碱性和酸性的物质,所以氢氧化钠、盐酸的体积都是小于20mL,醋酸根离子和铵根离子的水解程度一样,所以两种溶液体积相等,故D错误.
故选B.
点评 本题考查中和滴定、离子浓度大小比较,关键是根据滴定曲线判断相互滴定的物质,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解判断溶液中离子浓度大小.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.用下列装置进行实验,能达到相应实验目的是( )
| A. | 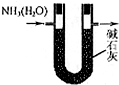 用如图装置干燥氨气 | |
| B. | 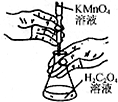 用如图装置进行高锰酸钾溶液滴定草酸溶液实验 | |
| C. | 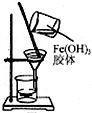 用如图装置可分离氢氧化铁胶体中Fe(OH)3和水 | |
| D. |  用如图装置可验证酸性:盐酸>碳酸>苯酚 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大.Y原子最外层电子数是内层电子数的3倍,X与Z位于同一主族,且与Y不在同一周期,W元素的最高正化合价与最低负化合价的代数和为零,下列说法正确的是( )
| A. | Y的气态氢化物的沸点在同主族中最高,所以其气态氢化物最稳定 | |
| B. | W的氧化物与X、Z形成的化合物中所含化学键相同 | |
| C. | 简单离子半径:W>Z>Y | |
| D. | 单质的氧化性:Y>W |
15.有机物  苯环上的四溴取代物同分异构体有( )
苯环上的四溴取代物同分异构体有( )
 苯环上的四溴取代物同分异构体有( )
苯环上的四溴取代物同分异构体有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
2.下列关于有机化合物说法正确的是( )
| A. | 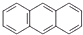 (蒽)和 (蒽)和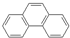 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 | |
| B. | 一般不能使用过酸的洗涤剂洗涤棉织品和丝织品,不能使用过碱的洗涤剂洗涤氨纶(聚氨基甲酸酯纤维)、腈纶(聚丙烯腈)等合成纤维制品 | |
| C. | 异黄酮类物质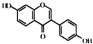 和酚类物质 和酚类物质 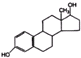 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) | |
| D. | 一定条件下将总质量相等的CH3OH、CH3COOH混合物或HCOOH、HOCOOCH2OH混合物在氧气中完全燃烧,燃烧后的全部产物通入足量过氧化钠层,过氧化钠层增加的质量之比为23:15 |
12.能正确表示下列反应的离子方程式是( )
| A. | 大理石溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | MnO2与浓盐酸反应制Cl2:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
16.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物溶于水后溶液呈碱性;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,下列说法正确的是( )
| A. | 简单离子的半径:W>Z>Y>X | |
| B. | W和M形成的化合物是离子化合物 | |
| C. | 五种元素中只有X存在同素异形体 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
20.下列物质中无Cl-的是( )
| A. | KCl溶液 | B. | KClO3 | C. | NaCl晶体 | D. | 氯水 |
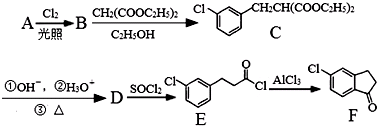
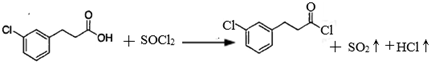 .
.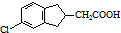 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: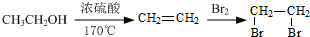
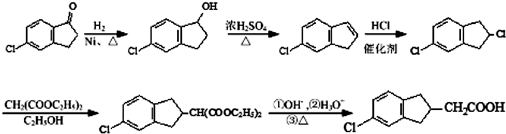 .
.