题目内容
7.下列元素在自然界有以游离态存在的是( )| A. | S | B. | Na | C. | Si | D. | Cl |
分析 根据元素的活泼性来判断元素在自然界的存在形式,硫以游离态存在、钠以化合态存在、硅以化合态存在、氯以化合态存在,据此解答.
解答 解:A.硫性质稳定,在自然界中以游离态存在,故A正确;
B.钠性质活泼,容易与空气中水、氧气反应,以化合态存在,故B错误;
C.硅为亲氧元素,极易与氧形成化合物,在自然界中不能以单质的形式存在,而以化合态存在,故C错误;
D.氯化学性质活泼,在自然界中只能以化合态存在,故D错误;
故选:A.
点评 本题考查了元素在自然界中的存在形态,题目难度不大,依据元素的活泼性即可判断解答,注意自然界中无游离态的硅.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.很多有机反应都会受反应条件的影响,同样的反应物,如果反应条件不同,其生成物可能截然不同,下列各项中不能体现这一观点的是( )
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 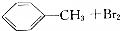 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
15.合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H<0,在合成氨工业生产中应采取的适宜条件是( )
| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
2.一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应,2SO2(g)+O2(g)?2SO3(g).反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
16.由N2O和NO反应生成N2和NO2的能量变化如图所示.下列说法错误的是( )
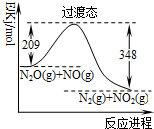

| A. | 使用催化剂可以降低过渡态的能量 | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ | |
| D. | 反应物的键能总和大于生成物的键能总和 |
17.下列实验操作或实验装置能达到实验目的是( )
| 选 项 | A | B | C | D |
| 实验操作或装置 |  |  |  |  |
| 实验目的 | 准确量取25.00mLNaOH溶液 | 分离乙醇与乙酸乙酯 | 从KI和I2的混合物中回收I2 | 实验室制取SO2 |
| A. | A | B. | B | C. | C | D. | D |

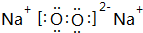 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);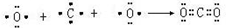 ;
;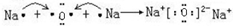 .
.