题目内容
15.合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H<0,在合成氨工业生产中应采取的适宜条件是( )| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
分析 该反应为气体体积缩小的反应,压强越大有利于氨气的生成;使用催化剂可以加快反应速率;该反应为放热反应,低温有利于氨气的生成,但是低温时反应速率较小,且催化剂在适当温度下才能更好的起到催化作用,使用需要选用适宜温度,据此进行解答.
解答 解:A.低温条件下,化学反应速率较慢,催化剂的催化活性受到影响,应该采用适宜温度,故A错误;
B.该反应为放热反应,高温下不利于氨气的合成,故B错误;
C.高压有利于氨气的合成,但是温度过高,平衡向着逆向移动,不利于氨气的生成,从反应速率、催化剂的催化活性角度考虑应该选用适宜温度,故C错误;
D.适宜的温度和压强下,可以提高反应物的转化率,使得催化剂的催化活性较高,让化学反应有利于正向进行,同时加入催化剂可以加快反应速率,故D正确;
故选D.
点评 本题考查了化学平衡及其影响,题目难度不大,正确判断工业合成氨的温度为解答关键,注意熟练掌握化学平衡及其影响,试题培养了学生的灵活应用能力.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
18. 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )| A. | a点时溶液的pH<1 | |
| B. | c点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+) | |
| C. | de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42-) | |
| D. | a点到b点的过程中,溶液的导电能力增强 |
6.25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
| A. | 12.5% | B. | 25% | C. | 50% | D. | 75% |
3.已知自然界的氧原子有3种:16O、17O、18O,氢原子有1H、2H,从水分子的原子构成来看,自然界的水共有( )
| A. | 2种 | B. | 6种 | C. | 9种 | D. | 12种 |
20.下列说法正确的是( )
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H<0,△S>0 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol | |
| C. | 铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
7.下列元素在自然界有以游离态存在的是( )
| A. | S | B. | Na | C. | Si | D. | Cl |
4.晶体从溶液中析出的过程称为结晶,结晶的方法有蒸发溶剂、冷却热饱和溶液等.
(1)已知某盐在不同温度下的溶解度(见下表)
若把质量分数为22%的该盐溶液由60℃逐渐冷却,则开始析出晶体的温度应在D(填字母)
A.0℃~10℃B.10℃~20℃C.20℃~30℃D.30℃~40℃
(2)t℃时,CuSO4在水中溶解度为25g,将32g CuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4•5H2O晶体析出,则m的取值范围是18<m<128.
(3)向50mL 4mol/L的NaOH溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.97g.请通过计算确定该无水物的成分.
(4)下面是四种盐在不同温度下的溶解度(克/100克水)
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计.)
取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度,过滤出晶体,计算所得晶体质量m1的值.将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体的质量m2的值.
(1)已知某盐在不同温度下的溶解度(见下表)
| T/℃ | 0 | 10 | 20 | 30 | 40 |
| S(g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
A.0℃~10℃B.10℃~20℃C.20℃~30℃D.30℃~40℃
(2)t℃时,CuSO4在水中溶解度为25g,将32g CuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4•5H2O晶体析出,则m的取值范围是18<m<128.
(3)向50mL 4mol/L的NaOH溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.97g.请通过计算确定该无水物的成分.
(4)下面是四种盐在不同温度下的溶解度(克/100克水)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度,过滤出晶体,计算所得晶体质量m1的值.将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体的质量m2的值.
5.下列说法中不正确的是( )
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 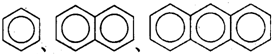 互为同系物 互为同系物 | |
| C. | 四氯乙烯分子中所有原子都处于同一平面 | |
| D. | 扁桃酸(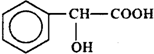 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 |