题目内容
19.有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,已知A原子核内无中子; B和C原子有相同的电子层数,且B的最外层电子数是次外层电子数的两倍,A和D、C和E分别同主族,D的单质在足量C单质燃烧生成淡黄色固态化合物,F与E相邻.试根据以上叙述回答:(1)元素名称A氢,B碳,C氧,D钠,E硫,F氯;
(2)F元素在周期表中的位置是第三周期第ⅦA族;
(3)用电子式表示下列物质:
D单质在足量C单质中燃烧生成的化合物:
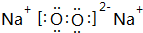 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”);E的气态氢化物:
 ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);(4)用电子式分别表示下列物质的形成过程:
BC2的形成过程
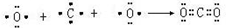 ;
;D2C的形成过程
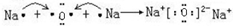 .
.
分析 有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,已知A原子核内无中子,应为H元素; B和C原子有相同的电子层数,位于相同周期,且B的最外层电子数是次外层电子数的两倍,则B为C元素,A和D、C和E分别同主族,D的单质在足量C单质燃烧生成淡黄色固态化合物,则C为O元素,D为Na元素,E为S元素,F与E相邻,应为Cl元素,以此解答该题.
解答 解:有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,已知A原子核内无中子,应为H元素; B和C原子有相同的电子层数,位于相同周期,且B的最外层电子数是次外层电子数的两倍,则B为C元素,A和D、C和E分别同主族,D的单质在足量C单质燃烧生成淡黄色固态化合物,则C为O元素,D为Na元素,E为S元素,F与E相邻,应为Cl元素,
(1)由以上分析可知,A、B、C、D、E、F分别属于氢、碳、氧、钠、硫、氯,故答案为:氢;碳;氧;钠;硫;氯;
(2)F为Cl元素,位于周期表第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
(3)D单质在足量C单质中燃烧生成的化合物为过氧化钠,属于离子化合物,电子式为 ,E为S,对应的氢化物为共价化合物,电子式为
,E为S,对应的氢化物为共价化合物,电子式为 ,
,
故答案为: ;离子;共价;
;离子;共价;
(4)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: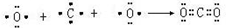 ,
,
氧化钠为离子化合物,形成过程为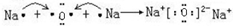 ,
,
故答案为: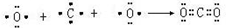 ;
;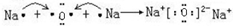 .
.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,注意对基础知识的理解掌握,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
2.莫尔盐,简称FAS,蓝绿色的无机复盐,在空气中逐渐风化及氧化,其名来源于德国化学家莫尔(Karl Friedrich Mohr).工业常用的制备方法是从废铁屑中回收铁屑(不含铁之外的其他金属元素),经碱溶液洗净之后,用过量硫酸溶解;再加入稍过量硫酸铵饱和溶液,在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂;过滤后用少量乙醇洗涤.莫尔盐的化学式可能是( )
| A. | NH4Fe(SO4)2•12H2O | B. | NH4Al(SO4)2•12H2O | C. | (NH4)2Fe(SO4)2•6H2O | D. | (NH4)2Fe(SO4)2 |
7.下列元素在自然界有以游离态存在的是( )
| A. | S | B. | Na | C. | Si | D. | Cl |
4.晶体从溶液中析出的过程称为结晶,结晶的方法有蒸发溶剂、冷却热饱和溶液等.
(1)已知某盐在不同温度下的溶解度(见下表)
若把质量分数为22%的该盐溶液由60℃逐渐冷却,则开始析出晶体的温度应在D(填字母)
A.0℃~10℃B.10℃~20℃C.20℃~30℃D.30℃~40℃
(2)t℃时,CuSO4在水中溶解度为25g,将32g CuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4•5H2O晶体析出,则m的取值范围是18<m<128.
(3)向50mL 4mol/L的NaOH溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.97g.请通过计算确定该无水物的成分.
(4)下面是四种盐在不同温度下的溶解度(克/100克水)
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计.)
取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度,过滤出晶体,计算所得晶体质量m1的值.将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体的质量m2的值.
(1)已知某盐在不同温度下的溶解度(见下表)
| T/℃ | 0 | 10 | 20 | 30 | 40 |
| S(g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
A.0℃~10℃B.10℃~20℃C.20℃~30℃D.30℃~40℃
(2)t℃时,CuSO4在水中溶解度为25g,将32g CuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4•5H2O晶体析出,则m的取值范围是18<m<128.
(3)向50mL 4mol/L的NaOH溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.97g.请通过计算确定该无水物的成分.
(4)下面是四种盐在不同温度下的溶解度(克/100克水)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度,过滤出晶体,计算所得晶体质量m1的值.将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体的质量m2的值.
8.硝酸与金属反应时,浓度越稀还原产物价态越低.现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示.下列结论正确的是( )
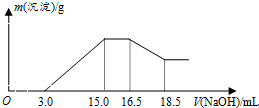

| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
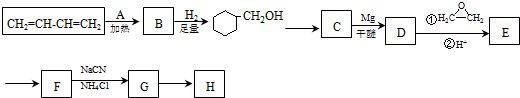
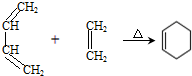

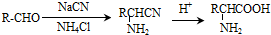
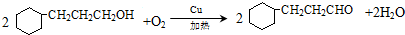 .
.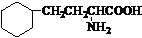 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式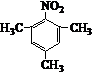 、
、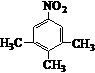 .
.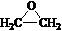 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).