题目内容
下列离子方程式中正确的是( )
| A、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、金属钠跟水反应:Na+H2O═Na++OH-+H2↑ |
| C、澄清的石灰水跟盐酸反应:H++OH-═H2O |
| D、氯气与水反应Cl2+H2O?2H++Cl-+ClO- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氢离子与氢氧根离子的计量数不满足硫酸、氢氧化钡的化学式组成;
B.根据质量守恒定律判断,该离子方程式两边氢原子数目不相等;
C.澄清石灰水中,氢氧化钙在离子方程式中需要拆开;
D.反应生成的次氯酸为弱电解质,离子方程式中应该保留分子式.
B.根据质量守恒定律判断,该离子方程式两边氢原子数目不相等;
C.澄清石灰水中,氢氧化钙在离子方程式中需要拆开;
D.反应生成的次氯酸为弱电解质,离子方程式中应该保留分子式.
解答:
解:A.H2SO4与Ba(OH)2溶液反应生成硫酸钡和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.金属钠跟水反应生成氢氧化钠和氢气,离子方程式必须满足质量守恒,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.澄清的石灰水跟盐酸反应生成氯化钙和水,反应的离子方程式为:H++OH-═H2O,故C正确;
D.气与水反应生成氯化氢和次氯酸,次氯酸为弱酸,离子方程式中需要保留分子式,正确的离子方程式为Cl2+H2O?H++Cl-+HClO,故D错误;
故选C.
B.金属钠跟水反应生成氢氧化钠和氢气,离子方程式必须满足质量守恒,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.澄清的石灰水跟盐酸反应生成氯化钙和水,反应的离子方程式为:H++OH-═H2O,故C正确;
D.气与水反应生成氯化氢和次氯酸,次氯酸为弱酸,离子方程式中需要保留分子式,正确的离子方程式为Cl2+H2O?H++Cl-+HClO,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
用NA表示阿伏加德罗常数数值,下列叙述正确的是( )
| A、64g SO2中含有的氧原子数为1NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1NA |
| C、常温常压下,14g N2含有分子数为0.5NA |
| D、标准状况下,22.4L H2O的分子数为1NA |
35Cl、37Cl、35Cl-、37Cl-是( )
| A、氯元素的四种同位素 |
| B、氯元素的 四种核素 |
| C、氯元素的四种同素异形体 |
| D、氯元素的四种不同粒子 |
下列有关物质的性质属于物理性质的是( )
| A、硫酸的酸性 |
| B、盐酸的挥发性 |
| C、碳酸的不稳定性 |
| D、氢气的还原性 |
下列叙述中正确的是(NA代表阿伏加德罗常数的值)( )
| A、常温常压下,0.1mol/L CH3COOH中所含H+数目为0.1NA |
| B、78gNa2O2与水充分反应,转移的电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中由水电离产生的OH-数目为0.1NA |
| D、电解精炼铜时,若电池中转移2NA个电子,则阴极质量增加64g |
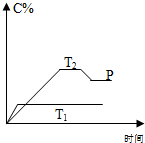 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问: