题目内容
5.室温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | pH=12的溶液中:AlO2-、Na+、SO42-、SO32- | |
| B. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| C. | 加入甲基橙呈黄色的溶液:NH4+、Fe2+、Cl-、NO3- | |
| D. | c(H+)=0.10 mol•L-1的溶液中:CH3COO-、NH4+、Cl-、Na+ |
分析 A.pH=12的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
B.水电离出的c(H+)=1×10-12 mol•L-1的溶液中存在大量氢离子或氢氧根离子,偏铝酸根离子与氢离子反应;
C.加入甲基橙呈黄色的溶液的pH大于4.4,可能为酸性或碱性溶液,铵根离子、亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.醋酸根离子与氢离子反应生成弱电解质醋酸.
解答 解:A.pH=12的溶液为碱性溶液,溶液中存在大量氢氧根离子,AlO2-、Na+、SO42-、SO32-之间不发生反应,都不与氢氧根离子反应,在溶液中不能大量共存,故A正确;
B.水电离出的c(H+)=1×10-12 mol•L-1的溶液中存在大量氢离子或氢氧根离子,AlO2-与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.加入甲基橙呈黄色的溶液为酸性或碱性溶液,NH4+、Fe2+与氢氧根离子反应,Fe2+、NO3-之间在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.CH3COO-与氢离子结合生成醋酸,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.有关钴和铁化合物的性质见下表.用含钴废料(含少量铁)可制备氯化钴:Co+2HCl═CoCl2+H2↑,工艺流程如下,试回答:
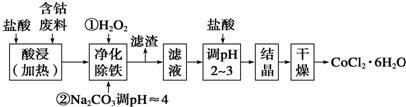
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH-.
(2)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
(3)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)滤液的主要成分是CoCl2、NaCl、HCl.
(5)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.

| 物质 | 溶度积Ksp | 沉淀完全时的pH |
| Co(OH)2 | 5.9×10-15 | 9.4 |
| Fe(OH)2 | 1.6×10-14 | 9.6 |
| Fe(OH)3 | 1.1×10-36 | 3.7 |
(2)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
(3)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)滤液的主要成分是CoCl2、NaCl、HCl.
(5)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.
16.室温下,下列粒子一定能大量共存的是( )
| A. | 使酚酞变红色的溶液:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水:K+、Na+、Cl-、HSO3- | |
| C. | pH=13溶液:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L KNO3溶液:H+、Fe2+、Cl-、SO32- |
20.下列离子方程式书写正确的是( )
| A. | 用氨水吸收少量SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 碳酸氢镁溶液中加入过量石灰水Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| C. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
10.某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述中正确的( )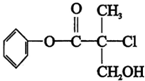

| A. | 有机物A属于芳香烃 | |
| B. | 有机物A可以和Br的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A可与NaOH溶液反应,生成多种可溶于水的化合物 |
17.勒沙特列原理是自然界一条重要的基本原理.下列事实不能用勒沙特列原理解释的是( )
| A. | NO2气体受压缩后,颜色先变深后变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系加压,颜色迅速变深 | |
| C. | 合成氨工业采用高温、高压工艺提高氨的产率 | |
| D. | 配制硫酸亚铁溶液时,常加入少量铁屑防止氧化 |
14.50mL的酸式滴定管中,某浓度HCl溶液在30mL处,则该HCl溶液的体积为( )
| A. | 大于30mL | B. | 等于30mL | C. | 大于20mL | D. | 等于20mL |
15.下列离子方程式正确的是( )
| A. | 铁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铁和铜反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 石灰水与碳酸钠溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ |