题目内容
17.勒沙特列原理是自然界一条重要的基本原理.下列事实不能用勒沙特列原理解释的是( )| A. | NO2气体受压缩后,颜色先变深后变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系加压,颜色迅速变深 | |
| C. | 合成氨工业采用高温、高压工艺提高氨的产率 | |
| D. | 配制硫酸亚铁溶液时,常加入少量铁屑防止氧化 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、存在平衡2NO2(g)?N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,由于平衡移动的目的是减弱变化,而不是消除,故颜色仍不原来的颜色深,所以可以用平衡移动原理解释,故A正确;
B、加压,两边气体的计量数相等,所以加压平衡不移动,所以不可以用平衡移动原理解释,故B错误;
C、增大压强平衡向正反应移动,原料利用率提高,氨气产率增大,高压比常压条件更有利于合成氨的反应,可以用勒夏特列原理解释,故C正确;
D、配制FeSO4溶液时,加入一些铁粉目的是防止亚铁离子被氧化成铁离子,不能用勒夏特列原理解释,故D错误;
故选BD.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
8.分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是( )
| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应前后是否有元素化合价变化,可将化学反应分为氧化还原反应和非氧化还原反应 |
5.室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=12的溶液中:AlO2-、Na+、SO42-、SO32- | |
| B. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| C. | 加入甲基橙呈黄色的溶液:NH4+、Fe2+、Cl-、NO3- | |
| D. | c(H+)=0.10 mol•L-1的溶液中:CH3COO-、NH4+、Cl-、Na+ |
12.下列说法正确的是( )
| A. | 按系统命名法,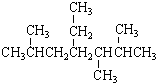 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 已知1mol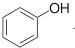 可以与1molNaOH发生反应.则1mol 可以与1molNaOH发生反应.则1mol 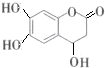 与足量的NaOH溶液发生反应时,需消耗4molNaOH 与足量的NaOH溶液发生反应时,需消耗4molNaOH | |
| D. | 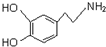 属于氨基酸,既能与强酸反应,又能与强碱反应 属于氨基酸,既能与强酸反应,又能与强碱反应 |
2.某晶体中含有极性键,关于该晶体的说法错误的是( )
| A. | 不可能有很高的熔沸点 | B. | 不可能是金属晶体 | ||
| C. | 可能是有机物 | D. | 可能是离子晶体 |
6.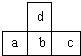 如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )
如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )
 如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )
如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | d与c不能形成化合物 | |
| D. | 原子半径的大小顺序是a>b>c>d |