题目内容
13.已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.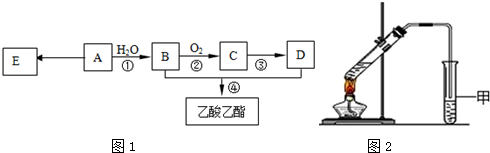
(1)A分子中官能团的名称是碳碳双键,D中官能团的名称是羧基;反应①的反应类型是加成反应.
(2)反应②的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应④的化学方程式是CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)E是常见的高分子材料,合成E的化学方程式是nCH2=CH2$\stackrel{一定条件下}{→}$
 .
.(4)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体.
①实验开始时,试管甲中的导管不伸入液面下的原因是防倒吸.
②上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,不能(能/不能)生成1mol 乙酸乙酯,原因是该反应为可逆反应,有一定的限度,不可能完全转化.
分析 有机物A的产量可以用来衡量一个国家的石油化工发展水平,则A是CH2=CH2,CH2=CH2和H2O反应生成CH3CH2OH,则B是CH3CH2OH,CH3CH2OH被O2氧化生成C,C反应生成D,D和乙醇反应生成乙酸乙酯,则D是CH3COOH,C是CH3CHO,A反应生成E,E是高分子化合物,则E结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:有机物A的产量可以用来衡量一个国家的石油化工发展水平,则A是CH2=CH2,CH2=CH2和H2O反应生成CH3CH2OH,则B是CH3CH2OH,CH3CH2OH被O2氧化生成C,C反应生成D,D和乙醇反应生成乙酸乙酯,则D是CH3COOH,C是CH3CHO,A反应生成E,E是高分子化合物,则E结构简式为 ,
,
(1)A是CH2=CH2,D是CH3COOH,A中官能团名称是碳碳双键、D中官能团名称是羧基,反应①的反应类型是加成,故答案为:碳碳双键;羧基;加成.
(2)该反应为乙醇的催化氧化反应,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应④为乙酸和乙醇的酯化反应,该反应的化学方程式是CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(3)E是聚乙烯,乙烯发生加聚反应生成聚乙烯,反应方程式为:nCH2=CH2$\stackrel{一定条件下}{→}$ ,故答案为:nCH2=CH2$\stackrel{一定条件下}{→}$
,故答案为:nCH2=CH2$\stackrel{一定条件下}{→}$ ;
;
(4)①实验开始时,试管甲中的导管不伸入液面下是为了防止倒吸,故答案为:防倒吸;
②饱和碳酸钠溶液能溶解乙醇,能和乙酸反应生成二氧化碳和可溶性的乙酸钠,能降低乙酸乙酯溶解度,从而更好的析出乙酸乙酯,故选BC;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,不能生成1mol乙酸乙酯,因为该反应是可逆反应,当反应达到一定限度时达到平衡状态,故答案为:不能;该反应为可逆反应,有一定的限度,不可能完全转化.
点评 本题考查有机物推断和乙酸乙酯的制取,为高频考点,明确官能团及其性质关系、乙酸乙酯制取方法及原理是解本题关键,注意乙酸乙酯制取中饱和碳酸钠溶液的作用,不能将饱和碳酸钠溶液换为NaOH溶液,为易错点.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 氧化还原反应的实质是电子转移 | B. | 氧化剂在反应中本身被还原 | ||
| C. | 氧化反应和还原反应同时进行 | D. | 氧化还原反应一定有单质参加 |
| A. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| B. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
| A. | S2-的结构示意图: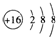 | B. | 中子数为10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的电子式: | D. | 硝基苯的结构简式: |
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
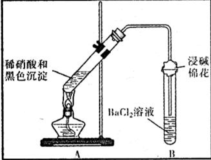 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
| A. | 能说明H2CO3是弱电解质:HCO3-+H2O?H2CO3+OH- | |
| B. | 能说明溶解性AgCl强于AgI:AgCl+I-═Cl-+AgI | |
| C. | 能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 | |
| D. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
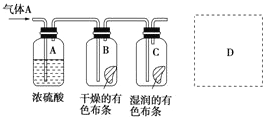
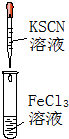
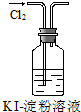
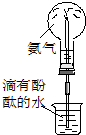
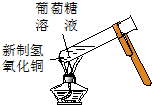

 ;A→F
;A→F