题目内容
18.下列有关化学用语表述正确的是( )| A. | S2-的结构示意图: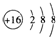 | B. | 中子数为10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的电子式: | D. | 硝基苯的结构简式: |
分析 A.S2-的最外层电子数为8,核外电子总数为18;
B.氧原子的质子数为8,中子数为10的氧原子的质量数为18;
C.次氯酸的中心原子为O原子,不存在H-Cl键;
D.硝基苯结构简式中,硝基的书写不规范,应该表示为:O2N-.
解答 解:A.S2-的结构示意图中,最外层电子数为8,硫离子正确的结构示意图为: ,故A正确;
,故A正确;
B.氧原子的质子数为8,中子数为10的氧原子的质量数为18,该原子可以表示为:188O,故B错误;
C.次氯酸为共价化合物,中心原子为O原子,次氯酸正确的电子式为 ,故C错误;
,故C错误;
D.硝基写在苯环左侧时,应该表示为:O2N-,硝基苯正确的结构简式为: ,故D错误.
,故D错误.
故选A.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及结构示意图、元素符号、电子式、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,22.4L SO3的分子数约为NA个 | |
| B. | 58.5g NaCl溶于1 L水中,所得溶液中溶质的物质的量浓度为1 mol/L | |
| C. | 常温、常压下,48g臭氧含有的氧原子数为3NA | |
| D. | 5.6g Fe与足量的盐酸反应失去的电子数为0.3NA |
9.下列实验方法错误的是( )
| A. | 除去氯化钾中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去Na2CO3固体中混有的NaHCO3:加热至恒重 | |
| C. | 除去食盐中的泥沙:溶于水,过滤,滤液蒸发结晶 | |
| D. | 从溴水中提取溴单质:加入酒精萃取 |
6.下列化学用语书写正确的是( )
| A. | 乙烯的结构简式 CH2CH2 | |
| B. | 氯离子的结构示意图: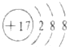 | |
| C. | H2O的电子式: | |
| D. | 碳酸钾的电离方程式 K2SO4=K2++SO42- |
10.下列不属于正在研究和开发的新能源是( )
| A. | 天然气 | B. | 生物质能 | C. | 氢能 | D. | 太阳能 |
7.14g铜银合金与足嫩的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
20. A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表
请根据表中的信息回答下列问题:
(1)D离子的结构示意图: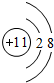 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: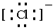 .
.
(2)写出和B的氢化物所含电子数相同的3种微粒:CH4,H2O,HF.
(3)A元素与E元素组成的化合物的电离方程式:HCl=H++Cl-.
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式K+.
(5)硼(B)有两种同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%(只需列出式子,不必计算出结果 ).
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
(1)D离子的结构示意图:
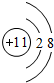 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: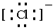 .
.(2)写出和B的氢化物所含电子数相同的3种微粒:CH4,H2O,HF.
(3)A元素与E元素组成的化合物的电离方程式:HCl=H++Cl-.
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式K+.
(5)硼(B)有两种同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%(只需列出式子,不必计算出结果 ).
 .
.