题目内容
2.下列所述事实与化学(或离子)方性式不相符的是( )| A. | 能说明H2CO3是弱电解质:HCO3-+H2O?H2CO3+OH- | |
| B. | 能说明溶解性AgCl强于AgI:AgCl+I-═Cl-+AgI | |
| C. | 能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 | |
| D. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
分析 A.存在电离平衡;
B.发生沉淀的转化;
C.盐酸、硝酸均为强酸;
D.NH3结合H+生成铵根离子.
解答 解:A.存在电离平衡H2CO3?HCO3-+H+、HCO3-?CO32-+H+,可知为弱电解质,故A选;
B.发生沉淀的转化AgCl+I-═Cl-+AgI,可知溶解性AgCl强于AgI,故B不选;
C.盐酸、硝酸均为强酸,而HCl+AgNO3═AgCl↓+HNO3发生,与AgCl溶解性有关,故C选;
D.NH3结合H+生成铵根离子,由NH3+H3O+═NH4++H2O可知,NH3结合H+能力比H2O强,故D不选;
故选AC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的应用,题目难度不大.

练习册系列答案
相关题目
10.下列不属于正在研究和开发的新能源是( )
| A. | 天然气 | B. | 生物质能 | C. | 氢能 | D. | 太阳能 |
17.现有含FeCl2杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
请回答下列问题:
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).
7.14g铜银合金与足嫩的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
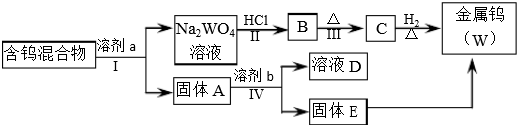
3.分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程示意图如所示.
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
(1)步骤Ⅰ和Ⅳ均要进行的操作是过滤.
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O.
(3)WO3既属于金属氧化物,也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是将WO3溶解同时又能保证不被氧化W2O5.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4.

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O.
(3)WO3既属于金属氧化物,也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是将WO3溶解同时又能保证不被氧化W2O5.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4.
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12LCCl4含有Cl原子数目为0.4NA | |
| B. | 标准状况下,2.24L氯气中含有的电子总数为3.4mol | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 39gNa2O2与足量H2O反应,转移电子数为NA |
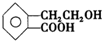 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.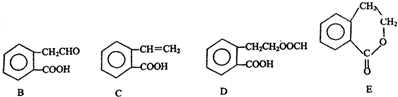
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O.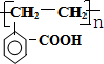 .
.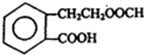 +2NaOH$\stackrel{△}{→}$HCOONa+
+2NaOH$\stackrel{△}{→}$HCOONa+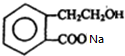 +2H2O.
+2H2O.
 .
.