题目内容
4.下列叙述中,不正确的是( )| A. | 氧化还原反应的实质是电子转移 | B. | 氧化剂在反应中本身被还原 | ||
| C. | 氧化反应和还原反应同时进行 | D. | 氧化还原反应一定有单质参加 |
分析 氧化还原反应的特征为化合价的变化,实质为电子转移,氧化与还原同时发生,共存于同一反应中,反应中不一定存在单质,以此来解答.
解答 解:A.氧化还原反应的特征为化合价的变化,实质为电子转移,故A正确;
B.氧化剂在反应中得到电子,本身被还原,故B正确;
C.氧化反应和还原反应同时进行,共存于同一反应中,故C正确;
D.氧化还原反应不一定有单质参加,如过氧化钠与二氧化硫反应生成硫酸钠,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应的特点及实质为解答的关键,侧重基础知识的考查,注意选项D结合实例分析,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
14.下列叙述正确的是( )
| A. | 1mol H2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 标准状况下,1molH2O体积是22.4L |
15.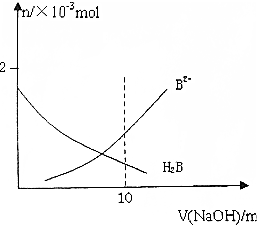 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
19.下列离子方程式中,书写正确的是( )
| A. | NaHCO3在水溶液中水解:HCO3-+H2O?H3O++CO32- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
9.下列实验方法错误的是( )
| A. | 除去氯化钾中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去Na2CO3固体中混有的NaHCO3:加热至恒重 | |
| C. | 除去食盐中的泥沙:溶于水,过滤,滤液蒸发结晶 | |
| D. | 从溴水中提取溴单质:加入酒精萃取 |
16.下列说法正确的是( )
| A. | 含有盐酸的洁厕剂和含有次氯酸钠的消毒液混用可以增强洗涤和消毒的效果 | |
| B. | 过量的Fe和Cu在等物质的量的Cl2中燃烧,转移的电子数相等 | |
| C. | 等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 | |
| D. | 等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2:1 |
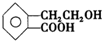 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.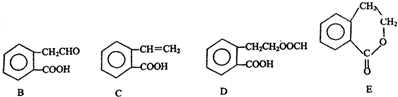
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O.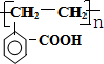 .
.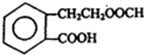 +2NaOH$\stackrel{△}{→}$HCOONa+
+2NaOH$\stackrel{△}{→}$HCOONa+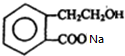 +2H2O.
+2H2O.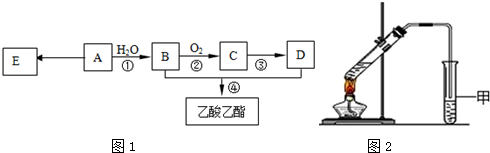
 .
.