题目内容
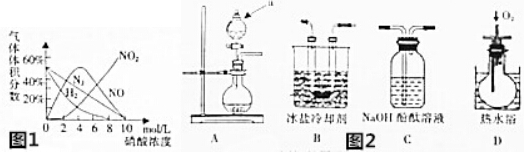
8.实验是化学研究的基础.下列对实验现象的描述正确的是( )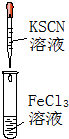 | 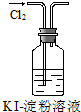 | 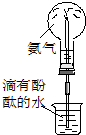 | 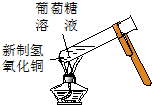 |
| ① | ② | ③ | ④ |
| A. | 实验①试管中混合溶液中出现红色沉淀 | |
| B. | 实验②中溶液变黄色 | |
| C. | 实验③中烧瓶内溶液变红色 | |
| D. | 实验④中出现黑色氧化铜固体 |
分析 A.铁离子与KSCN结合生成络离子;
B.氯气与KI反应生成碘单质;
C.氨气极易溶于水,且溶液显碱性;
D.葡萄糖中含-CHO,与新制氢氧化铜反应生成氧化亚铜.
解答 解:A.铁离子与KSCN结合生成络离子,则观察到溶液变为血红色,故A错误;
B.氯气与KI反应生成碘单质,淀粉遇碘单质变蓝,则观察到溶液变为蓝色,故B错误;
C.氨气极易溶于水,且溶液显碱性,则可观察到红色喷泉,故C正确;
D.葡萄糖中含-CHO,与新制氢氧化铜反应生成氧化亚铜,则可观察到砖红色沉淀,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握常见物质的性质及离子检验为解答的关键,注意方案的评价性和操作性分析,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
18.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 在常温常压下,28 g N2含有的分子数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 标准状况下,1mol CCl4的体积约为22.4 L | |
| D. | 2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
19.下列离子方程式中,书写正确的是( )
| A. | NaHCO3在水溶液中水解:HCO3-+H2O?H3O++CO32- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
16.下列说法正确的是( )
| A. | 含有盐酸的洁厕剂和含有次氯酸钠的消毒液混用可以增强洗涤和消毒的效果 | |
| B. | 过量的Fe和Cu在等物质的量的Cl2中燃烧,转移的电子数相等 | |
| C. | 等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 | |
| D. | 等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2:1 |
3.实验室里也可以利用以下反应制取少量氯气:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3H2O+3Cl2↑,关于该反应的说法正确的是( )
| A. | KClO3中的氯元素被氧化 | |
| B. | Cl2既是氧化剂,又是还原剂 | |
| C. | 还原剂是HCl | |
| D. | 每生成1mol Cl2转移电子的物质的量为6mol |
20.某有机化合物的结构简式为  Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
 Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
17.现有含FeCl2杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
请回答下列问题:
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).
 .
.