题目内容
3.某学生应用如图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题: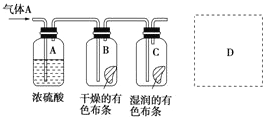
(1)该项研究(实验)的主要目的是探究Cl2在潮湿和干燥时是否具有漂白性.
(2)浓硫酸的作用是吸收气体A中的水蒸气,与研究目的直接相关的实验现象是B内的有色布条不退色,C内的有色布条退色
(3)该实验装置设计上存在的缺陷为没有尾气处理装置,造成环境污染.请在如图的D处画出能克服该缺陷的装置图.
(4)实验室保存饱和氯水的方法是在阴凉处置于棕色试剂瓶中密封保存.
(5)将石蕊试液滴到新制氯水中的现象石蕊试液先变红后褪色.
分析 (1)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,通过BC有色布条的颜色变化即可判断氯气是否具有漂白性;
(2)氯气中含有水蒸气,要验证干燥氯气不具有漂白性,应除去氯气中的水蒸气;依据BC瓶中有色布条是否褪色即可判断氯气是否具有漂白性;
(3)氯气有毒,不能直接排放,应进行尾气吸收;
(4)氯水中的次氯酸见光易分解,导致氯水失效;
(5)新制的氯水中含HCl、HClO,具有酸性和漂白性.
解答 解:(1)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,通过BC有色布条的颜色变化即可判断氯气是否具有漂白性,故答案为:探究Cl2在潮湿和干燥时是否具有漂白性;
(2)氯气中含有水蒸气,要验证干燥氯气不具有漂白性,应除去氯气中的水蒸气,浓硫酸具有吸水性,可以吸收氯气中的水蒸气;
氯气不具有漂白性,所以B瓶中有色布条不褪色,次氯酸具有漂白性,所以C中湿润的有色布条褪色,通过有色布条是否褪色,可以判断氯气是否具有漂白性,故答案为:吸收气体A中的水蒸气;B内的有色布条不退色,C内的有色布条退色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,装置图为 ,故答案为:没有尾气处理装置,造成环境污染;
,故答案为:没有尾气处理装置,造成环境污染;  ;
;
(4)氯水中的次氯酸见光易分解,新制氯水通常保存在棕色试剂瓶中,故答案为:在阴凉处置于棕色试剂瓶中密封保存;
(5)新制的氯水中含HCl、HClO,则石蕊试液滴加到新制的氯水中,石蕊遇酸变红色,然后被HClO漂白,则观察到褪色,即溶液先变红后褪色,故答案为:石蕊试液先变红后褪色.
点评 本题为实验题,考查了氯气的性质的检验,明确氯气及次氯酸的性质是解题关键,侧重考查学生分析为题解题问题的能力,注意实验设置的严密性,题目难度不大.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案| A. | 1mol H2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 标准状况下,1molH2O体积是22.4L |
| A. | 1.5g | B. | 3g | C. | 5g | D. | 无法确定 |
| A. | 在常温常压下,28 g N2含有的分子数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 标准状况下,1mol CCl4的体积约为22.4 L | |
| D. | 2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
| A. | 在标准状况下,22.4L SO3的分子数约为NA个 | |
| B. | 58.5g NaCl溶于1 L水中,所得溶液中溶质的物质的量浓度为1 mol/L | |
| C. | 常温、常压下,48g臭氧含有的氧原子数为3NA | |
| D. | 5.6g Fe与足量的盐酸反应失去的电子数为0.3NA |
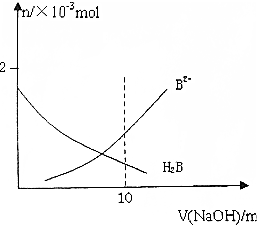 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
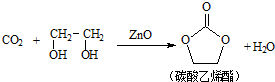
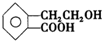 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.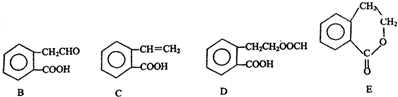
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O.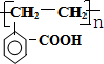 .
.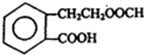 +2NaOH$\stackrel{△}{→}$HCOONa+
+2NaOH$\stackrel{△}{→}$HCOONa+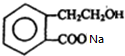 +2H2O.
+2H2O.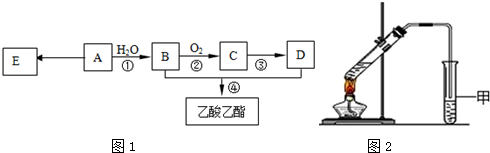
 .
.