题目内容
14.有关钠的化合物的说法正确的是( )| A. | Na2O和Na2O2都能与水反应生NaOH,它们都是碱性氧化物 | |
| B. | 向饱和NaCO3溶液中通人足量CO2,反应的离子方程式为CO2+H2O+CO32-=2HCO3- | |
| C. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 | |
| D. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 |
分析 A.能和水反应只生成碱的氧化物是碱性氧化物;
B.碳酸氢钠溶解度小于碳酸钠,向饱和NaCO3溶液中通人足量CO2,会产生沉淀;
C.有新物质生成的为化学变化;
D.钠是活泼的金属,易与水、氧气发生反应,工业上冶炼钠是电解熔融氯化钠得到;
解答 解:A.过氧化钠与水反应生成氢氧化钠和氧气,不属于碱性氧化物,故A错误;
B.向饱和NaCO3溶液中通人足量CO2,反应的离子方程式为2Na++CO2+H2O+CO32-=2NaHCO3↓,故B错误;
C.Na2CO3•10H2O的风化生成Na2CO3,有新物质生成属于化学变化,故C错误;
D.工业上冶炼钠是电解熔融氯化钠得到,2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,金属钠和水、氧气都能发生剧烈反应,所以冶炼应在无水条件下进行,故D正确;
故选:D.
点评 本题考查了元素化合物知识,涉及钠及其化合物,明确相关物质的性质是解题关键,注意碱性氧化物概念、物理变化与化学变化区别,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下1L 0.1 mol•L-1的FeSO4溶液中含有0.4NA个氧原子 | |
| B. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L | |
| C. | 1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA | |
| D. | 常温下,pH=7的0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
12.下列选用的相关仪器,用品不符合实验要求的是( )
| 选项 | 实验 | 仪器用品 |
| A | 准确量取19.01mL水 | 25mL酸式滴定管 |
| B | 新制氯水的保存 | 带玻璃塞的棕色细口瓶 |
| C | 测定0.1mol•L-1的Na2CO3溶液的pH | 镊子、pH试纸、表面皿 |
| D | 分离水和乙酸乙酯 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
6.下列微粒中,核外电子总数为10的是( )
| A. | Na+ | B. | CO2 | C. | CO | D. | N2 |
4.如图是元素周期表的一部分,关于元素X、Y、Z的叙述不正确的是( )
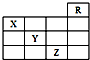

| A. | Z的原子序数比Y大19 | |
| B. | Z的单质常温下是深棕色液体,具有氧化性 | |
| C. | 同浓度的Y、Z的气态氢化物的水溶液的酸性Y>Z | |
| D. | X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐 |
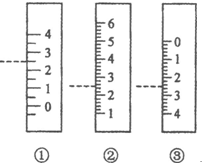 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验: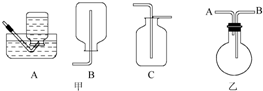
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: