题目内容
6.下列微粒中,核外电子总数为10的是( )| A. | Na+ | B. | CO2 | C. | CO | D. | N2 |
分析 原子中核外电子数=核内质子数=原子序数,分子中核外电子数=各元素的原子序数×原子个数之和,阳离子中核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数,据此分析解答.
解答 解:A.钠离子带1个单位正电荷,核内有11个质子,则核外电子数为11-1=10,故A正确;
B.二氧化碳分子呈电中性,质子数等于电子数=6+2×8=22,故B错误;
C.CO分子呈电中性,质子数等于电子数=6+8=14,故C错误;
D.氮气分子呈电中性,质子数等于电子数=7×2=14,故D错误;
故选:A.
点评 本题考查了分子或离子核外电子数的计算,难度不大,明确阴阳离子中电子数和质子数、电荷数之间的关系是解本题的关键.

练习册系列答案
相关题目
3.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 | |
| D. | 微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体 |
14.有关钠的化合物的说法正确的是( )
| A. | Na2O和Na2O2都能与水反应生NaOH,它们都是碱性氧化物 | |
| B. | 向饱和NaCO3溶液中通人足量CO2,反应的离子方程式为CO2+H2O+CO32-=2HCO3- | |
| C. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 | |
| D. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 |
11.标准状况下,将VL HCl气体通入1L水中,得到密度为d g/ml的盐酸溶液,其溶质的质量分数为ω,物质的量浓度为c mol/L,则下列说法错误的是( )
| A. | 此盐酸溶液与蒸馏水等体积混合后,所得溶质的质量分数小于$\frac{ω}{2}$ | |
| B. | 此盐酸溶液与蒸馏水等质量混合后,所得溶液的物质的量浓度小于$\frac{c}{2}$ mol/L | |
| C. | c=$\frac{1000Vd}{36.5V+22400}$ | |
| D. | ω=$\frac{36.5V}{36.5V+22400}$ |
18.某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物;
②氨水和NaOH都是电解质;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是混合物;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和烟、雾都是胶体.
上述说法正确的是( )
①粗盐和酸雨都是混合物;
②氨水和NaOH都是电解质;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是混合物;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和烟、雾都是胶体.
上述说法正确的是( )
| A. | ①②③④ | B. | ①②④⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
15. 已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )
已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )
 已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )
已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )| A. | a点反应的还原剂是NaHSO3,被氧化的元素是碘元素 | |
| B. | b点反应的离子方程式是:3HSO3-+IO3-+3OH-═3SO42-+I-+3H2O | |
| C. | c点到d点的反应中共转移0.6mol电子 | |
| D. | 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+2IO3-═I2+5SO42-+3H++H2O |
16.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
| A. | 浓硫酸使胆矾晶体变白(脱水性) | |
| B. | 在加热条件下铜与浓硫酸反应(氧化性、酸性) | |
| C. | 蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性) | |
| D. | 浓硫酸可用来干燥某些气体(不挥发性) |
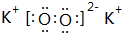 .
.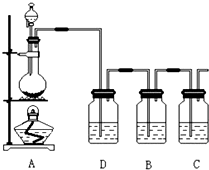 已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: