题目内容
2. 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:①用NaOH固体配0.10mol•L-1NaOH溶液1L
②取5mL食醋稀释至50mL
③取稀释后的食醋10mL放入锥形瓶中,滴入指示剂
④用NaOH标准液进行滴定
⑤滴定重复进行三次,求出滴定中所用标准液体积的平均值.
根据以上操作,回答下列问题:
(1)从下列选项中选出①、③操作中需要的仪器,用序号回答:bdeg.
a.250mL容量瓶 b.1000mL容量瓶 c.碱式滴定管 d.酸式滴定管
e.烧杯 f.烧瓶 g.胶头滴管 h.表面皿
(2)设⑤中所得标准液平均值为7.50mL,则食醋中醋酸的浓度为0.75mol•L-1,该醋酸与同物质的量浓度的盐酸均稀释至pH=4,加入水的体积:醋酸的<盐酸的(填“>”、“=”或“<”).
(3)若滴定管用水洗净后,未用标准液润洗,则食醋的浓度偏高(填“偏高”、“偏低”或“无影响”,下同);若锥形瓶用水洗净后,再用待测液润洗,则食醋的浓度偏高.
(4)该实验选用的指示剂最合适的是B.
A.甲基橙 B.酚酞 C.石蕊
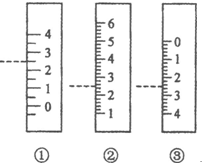
(5)如图是滴定管、量筒、温度计等玻璃仪器的一部分,下述读数(虚线刻度)及说法正确的是B.
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL
D.②是温度计,读数是2.5℃
分析 (1)依据配制溶液体积选择合适的容量瓶,根据配制一定物质的量浓度的溶液步骤选用仪器,食醋用酸式滴定管盛装;
(2)根据反应关系式NaOH~CH3COOH计算食醋中醋酸的浓度;醋酸是弱酸,部分电离;
(3)并用公式c(待)=$\frac{c(标)×V(标)}{V(待)}$分析误差;
(4)恰好完全反应时生成醋酸钠,溶液呈碱性,根据指示剂的变色范围选择;
(5)根据滴定管、量筒、温度计的构造及正确使用方法进行解答.
解答 解:(1)用NaOH固体配0.10mol•L-1NaOH溶液1L,配制一定物质的量浓度的溶液步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,需要的仪器有:天平、胶头滴管、烧杯、玻璃棒、1000mL容量瓶,用酸式滴定管装食醋,
故答案为:bdeg;
(2)标准液平均值为7.50mL,NaOH溶液的浓度为0.10mol•L-1,反应关系式为:NaOH~CH3COOH,
氢氧化钠的物质的量为:7.50×10-3L×0.10mol•L-1=7.50×10-4 mol,食醋的浓度为:c(CH3COOH)=$\frac{n(C{H}_{3}COOH)}{V(食醋)}$=$\frac{7.50×1{0}^{-4}mol}{10×1{0}^{-3}L}$=0.75mol/L;
醋酸是弱酸,部分电离,在醋酸与同物质的量浓度的盐酸中,稀释前盐酸中氢离子浓度比醋酸大得多,所以要使均稀释至pH=4,让酸性一致,盐酸加的水要多一些,
故答案为:0.75;<;
(3)滴定管用水洗净后,未用标准液润洗,使标准液变稀,最后达终点时消耗的标准液的体积增大,则结果偏高;锥形瓶用水洗净后,再用待测液润洗,使醋酸物质的量增多,消耗的标准液增多,则结果偏高;
故答案为:偏高;偏高;
(4)恰好完全反应时生成醋酸钠,溶液呈碱性,甲基橙的变色范围是3.1-4.4,酚酞的变色范围是8.2-10.0,故选酚酞做指示剂,
故答案为:B;
(5)A.量筒上没有0刻度值,故A错误;
B.量筒精确值为:0.1mL,图②中液体体积为2.5mL,故B正确;
C.滴定管精确度为0.01mL,故C错误;
D.温度计有0刻度且0刻度下还有数据,故D错误;
故答案为:B.
点评 本题考查了溶液配制与中和滴定实验,注意熟练掌握滴定管、量筒、温度计等仪器的构造及正确使用方法,能进行数据处理和计算,能对实验进行误差分析,试题培养了学生的化学实验能力,题目难度中等.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2 min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4 min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,到达平衡时n(CO2)<0.60 mol |
| 选项 | 目的 | 操作 | 现象和结论 |
| A | 实验室制较纯净乙烯 | 将浓硫酸、乙醇混合液加热至170℃,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色,说明除去了SO2,得到纯净乙烯气体 |
| B | 检验淀粉的水解程度 | 向混合溶液中直接加入银氨溶液,加热 | 没有出现银镜,说明淀粉还没有水解 |
| C | 验证甲烷与氯气发生取代反应 | 将过量的氯气与甲烷混合,光照一段时间后滴入硝酸银溶液 | 有白色沉淀产生,证明发生取代反应 |
| D | 比较碳酸与醋酸的酸性强弱 | 用pH计测定0.1mol•L-1的碳酸氢钠和醋酸钠的pH值 | 碳酸氢钠溶液的pH大,证明碳酸的酸性比醋酸弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 | |
| B. | 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡 | |
| C. | 电离平衡是相对有、暂时的、外界条件改变时,平衡就会发生移动 | |
| D. | 电解质达到电离平衡后,各种离子的浓度相等 |
| A. | Na2O和Na2O2都能与水反应生NaOH,它们都是碱性氧化物 | |
| B. | 向饱和NaCO3溶液中通人足量CO2,反应的离子方程式为CO2+H2O+CO32-=2HCO3- | |
| C. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 | |
| D. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 |
| A. | 此盐酸溶液与蒸馏水等体积混合后,所得溶质的质量分数小于$\frac{ω}{2}$ | |
| B. | 此盐酸溶液与蒸馏水等质量混合后,所得溶液的物质的量浓度小于$\frac{c}{2}$ mol/L | |
| C. | c=$\frac{1000Vd}{36.5V+22400}$ | |
| D. | ω=$\frac{36.5V}{36.5V+22400}$ |

 .
.