题目内容
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下1L 0.1 mol•L-1的FeSO4溶液中含有0.4NA个氧原子 | |
| B. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L | |
| C. | 1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA | |
| D. | 常温下,pH=7的0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
分析 A、在硫酸亚铁溶液中,除了硫酸亚铁外,水也含氧原子;
B、消耗MnO2 8.7g即0.1mol时,原电池能提供0.2mol电子,根据电子数守恒来分析制得的氯气的物质的量和体积;
C、CaCO3与Mg3N2的摩尔质量均为100g/mol,且两者中均含50个质子;
D、铵根离子是弱碱阳离子,在溶液中会水解.
解答 解:A、在硫酸亚铁溶液中,除了硫酸亚铁外,水也含氧原子,故溶液中的氧原子的个数大于0.4NA个,故A错误;
B、消耗MnO2 8.7g即0.1mol时,原电池能提供0.1mol电子,根据电子数守恒可知,在电解饱和食盐水时,阳极上失去0.1mol电子,生成0.05mol氯气,在标况下体积为1.12L,故B错误;
C、CaCO3与Mg3N2的摩尔质量均为100g/mol,故1.2g混合物的物质的量为0.012mol,且两者中均含50个质子,故0.012mol混合物中含0.6NA个质子,故C正确;
D、铵根离子是弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的浓度小于0.5mol/L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1. 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
I.制备
称取14.0g CuSOd•5H20、16.0g Na2CO3.10H20,用研钵分别研细后再混合研磨,立即发生反应,有“滋滋”声,而且混合物很快成为“黏胶状”.将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
(1)①混合物发生反应时有“滋滋”声的原因是有气体生成.
②检验生成物已洗涤干净的方法是取最后一次洗涤液少许于试管中,加入适量盐酸酸化后滴加氯化钡溶液,若无沉淀生成,则没有SO42-,否则含有SO42-
Ⅱ.组成测定
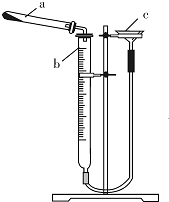
有同学查阅资料发现用Cu(OH)2.CuC03表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2.nCuC03,不同来源的碱式碳酸铜的m、n值需要具体测定.热分解法测定碱式碳酸铜组成的实验装置如图所示.通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值.
(2)①仪器b的名称是碱式滴定管.
②检查装置气密性的方法是连接好装置,通过漏斗向装置中加水,至右侧水面比左侧水面高,静置,水面高度差不发生变化,则装置不 漏气,否则装置漏气.
③三次平行实验测定结果如下表,则该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”、“偏小”或“不变”).
III.铜是生命必需的元素,也是人类广泛使用的金属.
(1)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物H2SO4 HCl(填写化学式).
(2)现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜.火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 $\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO,每转移0.6mol电子,有0.1mol硫被氧化.
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O.
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.I.制备
称取14.0g CuSOd•5H20、16.0g Na2CO3.10H20,用研钵分别研细后再混合研磨,立即发生反应,有“滋滋”声,而且混合物很快成为“黏胶状”.将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
(1)①混合物发生反应时有“滋滋”声的原因是有气体生成.
②检验生成物已洗涤干净的方法是取最后一次洗涤液少许于试管中,加入适量盐酸酸化后滴加氯化钡溶液,若无沉淀生成,则没有SO42-,否则含有SO42-
Ⅱ.组成测定
有同学查阅资料发现用Cu(OH)2.CuC03表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2.nCuC03,不同来源的碱式碳酸铜的m、n值需要具体测定.热分解法测定碱式碳酸铜组成的实验装置如图所示.通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值.
(2)①仪器b的名称是碱式滴定管.
②检查装置气密性的方法是连接好装置,通过漏斗向装置中加水,至右侧水面比左侧水面高,静置,水面高度差不发生变化,则装置不 漏气,否则装置漏气.
③三次平行实验测定结果如下表,则该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”、“偏小”或“不变”).
| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
(1)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物H2SO4 HCl(填写化学式).
(2)现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜.火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 $\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO,每转移0.6mol电子,有0.1mol硫被氧化.
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O.
2.2015年10月5日,中国女药学家屠呦呦因从传统中草药里找到了战胜疟疾的新药物--青蒿素(结构简式如图所示),而获得2015年诺贝尔生理学或医学奖,成为第一个获得自然科学领域诺贝尔奖的中国人.下列有关青蒿素的叙述正确的是( ) 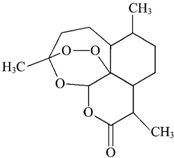

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 该有机物属于烃 | |
| C. | 分子中含有醚键、酯基、甲基三种官能团 | |
| D. | 能发生加成反应和取代反应 |
19.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
下列说法正确的是( )
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2 min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4 min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,到达平衡时n(CO2)<0.60 mol |
16.下列实验操作、现象、结论或解释均正确的是( )
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将某钾盐固体溶于盐酸 | 产生无色无味的气体 | 该钾盐是K2CO3 |
| B | 向可能含有Fe2+的Fe2(SO4)3溶液中加入酸性KMnO4溶液 | KMnO4溶液褪色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 向浓度均为0.1 mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
3.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 | |
| D. | 微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体 |
20.下列实验中,所采取的操作方法、对应现象和结论均正确的是( )
| 选项 | 目的 | 操作 | 现象和结论 |
| A | 实验室制较纯净乙烯 | 将浓硫酸、乙醇混合液加热至170℃,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色,说明除去了SO2,得到纯净乙烯气体 |
| B | 检验淀粉的水解程度 | 向混合溶液中直接加入银氨溶液,加热 | 没有出现银镜,说明淀粉还没有水解 |
| C | 验证甲烷与氯气发生取代反应 | 将过量的氯气与甲烷混合,光照一段时间后滴入硝酸银溶液 | 有白色沉淀产生,证明发生取代反应 |
| D | 比较碳酸与醋酸的酸性强弱 | 用pH计测定0.1mol•L-1的碳酸氢钠和醋酸钠的pH值 | 碳酸氢钠溶液的pH大,证明碳酸的酸性比醋酸弱 |
| A. | A | B. | B | C. | C | D. | D |
14.有关钠的化合物的说法正确的是( )
| A. | Na2O和Na2O2都能与水反应生NaOH,它们都是碱性氧化物 | |
| B. | 向饱和NaCO3溶液中通人足量CO2,反应的离子方程式为CO2+H2O+CO32-=2HCO3- | |
| C. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 | |
| D. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 |
 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: