题目内容
19.下列说法正确的是( )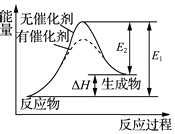
| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 | |
| C. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 | |
| D. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 |
分析 A、分子式为C2H4O的化合物可能为乙醛,还可能为环醚;
B、氯水是由于有强氧化性而具有漂白作用,而二氧化硫是和有色物质反应生成不稳定的无色物质;
C、催化剂能降低反应的活化能,但不能改变反应的热效应;
D、在途径a中,硫酸只做酸;而在途径b中,浓硫酸既做酸又做氧化剂.
解答 解:A、分子式为C2H4O的化合物有同分异构体,可能为乙醛,还可能为环醚,故化学性质不一定相同,故A错误;
B、氯水是由于有强氧化性而具有漂白作用,漂白效果稳定,而二氧化硫是和有色物质反应生成不稳定的无色物质,漂白效果不稳定,故B正确;
C、催化剂能改变反应的路径,从而降低反应的活化能,而反应的热效应取决于反应物和生成物的总能量,故催化剂不能改变反应的热效应,故C错误;
D、设铜粉的物质的量为1mol,则无论通过哪种途径转化,最终生成硫酸铜的物质的量为1mol.在途径a中,硫酸只做酸,故消耗的硫酸的物质的量为1mol;而在途径b中,浓硫酸既做酸又做氧化剂,根据生成的硫酸铜为1mol可知,做酸的硫酸为1mol,根据得失电子数守恒可知,做氧化剂的硫酸为1mol,故消耗的浓硫酸的物质的量共为2mol,即大于1mol,故D错误.
故选B.
点评 本题考查了催化剂在反应中的作用以及反应路径的选择,综合性较强,应注意的是浓硫酸在和铜反应时,浓硫酸既做酸又做氧化剂.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
7.某溶液中含有SO32-、CO32-、HCO3-、SO42-、Na+,向该溶液中加入足量的Na2O2,假设溶液体积变化忽略不计,下列说法不正确的是( )
| A. | 有气体生成 | |
| B. | Na+浓度基本不变 | |
| C. | HCO3-浓度减小而CO32-浓度增大 | |
| D. | SO32-发生反应的离子方程式为:SO32-+Na2O2+H2O=2Na++SO42-+2OH- |
4.下列反应的离子方程式书写正确的是( )
| A. | 铜溶于0.5 mol•L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向NH4HSO4溶液中滴加少量Ba(OH)2的溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO42-+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |
11. 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
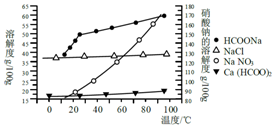
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
实验步骤
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
8.常温下,往5%的H2O2溶液中滴加2~3滴FeCl3溶液,可发生如下两个反应:
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
9.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为3NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |

 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.