题目内容
20.在炼油工业中常用醋酸铜氨溶液含{[Cu(NH3)2]+、CH3COO-和NH3}除去H2中的CO、O2及H2S气体.(1)已知醋酸铜氨溶液吸收CO的反应为:[Cu(NH3)2]+(aq)+CO(g)+NH3(g)?[Cu(NH3)2•CO]+(aq).
若反应在恒容密闭容器中进行,则能说明该反应已达到平衡状态的是bc.
a.v(CO)正=v(NH3)正
b.容器内气体压强不再随时间变化
c.[Cu(NH3)2]+浓度不再随时间变化
(2)醋酸铜氨溶液吸收CO一段时间后将失效,用下列方法可回收废醋酸铜氨溶液中的铜.

①“预处理”时,尾气中除N2、CO、O2、CO2及H2O外,还有NH3.
②加入硫化钠溶液时发生反应的离子方程式为Cu2++S2-=CuS↓.
③加入硝酸时发生反应的化学方程式为3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O.
④已知上述流程中只有“沉铜”和“结晶”步骤铜元素有损耗.“沉铜”时铜元素的损耗率为4%;“结晶”时铜元素的损耗率为2%.若1L废液最终制得Cu(NO3)2•3H2O 363g,则1L废液中铜元素的质量为102g.
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(2)废液中通入热空气进行预处理,使醋酸铜氨分解得到尾气中有CO、氨气和剩余空气,向溶液中加入硫酸得到硫酸铜、硫酸铵,向硫酸铜、硫酸铵中加入硫化钠溶液得到CuS和母液,将CuS加入硝酸中得到S、NO和硝酸铜,将硝酸铜溶液蒸发浓缩、冷却结晶、过滤得到硝酸铜晶体,结合题目分析解答.
解答 解:(1)a.无论反应是否达到平衡状态都存在v(CO)正=v(NH3)正,不能据此判断平衡状态,故错误;
b.反应前后气体压强减小,当容器内气体压强不再随时间变化时,正逆反应速率相等,反应达到平衡状态,故正确;
c.[Cu(NH3)2]+浓度不再随时间变化时,正逆反应速率相等,反应达到平衡状态,故正确;
故选bc;
(2)废液中通入热空气进行预处理,使醋酸铜氨分解得到尾气中有CO、氨气和剩余空气,向溶液中加入硫酸得到硫酸铜、硫酸铵,向硫酸铜、硫酸铵中加入硫化钠溶液得到CuS和母液,将CuS加入硝酸中得到S、NO和硝酸铜,将硝酸铜溶液蒸发浓缩、冷却结晶、过滤得到硝酸铜晶体
①通过以上分析知,还有NH3,故答案为:NH3;
②硫酸铜和硫化钠发生复分解反应生成黑色沉淀CuS,离子方程式为Cu2++S2-=CuS↓,故答案为:Cu2++S2-=CuS↓;
③硝酸溶解CuS生成S、NO、硝酸铜和水,反应方程式为3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O,
故答案为:3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O;
④363gCu(NO3)2•3H2O中Cu的质量=363g×$\frac{64}{242}$÷(1-2%)÷(1-4%)=102g,
故答案为:102.
点评 本题考查物质分离提纯及化学平衡状态判断,为高频考点,侧重考查学生获取信息、利用信息、元素化合物知识综合运用能力及分析判断能力,明确流程图中发生的反应及物质性质是解本题关键,题目难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案| A. | 己烷 苯 | B. | 己烯 苯 | C. | 己烯 甲苯 | D. | 己烷 己烯 |
| A. | 聚乙烯是无毒高分子化合物,可用作食品包装 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| D. | 电子垃圾的回收利用,可减少对土壤和水源的污染 |

回答下列问题:
(1)反应I的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,氧化剂为SiO2(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)反应III和IV中尾气的用途为制取盐酸;反应IV的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.
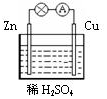
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2=CH3OH+H2O.
(2)在120℃,如下容积固定的密闭容器中,当活塞被固定在整个装置的中间,X与Y按(1)在Ⅰ中进行反应:
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.
| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 | |
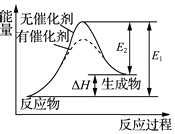
| C. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 | |
| D. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 |
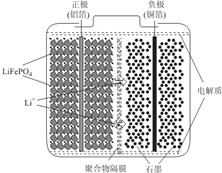 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.