题目内容
14. 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.已知:Ⅰ.CH2=CHCH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)△H1=-236.6kJ•mol-1
Ⅱ.CH3C CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)△H=-272.7kJ•mol-1
Ⅲ.C-C的键能为348kJ•mol-1;C=C的键能为612kJ•mol-1
请回答:
(1)CH2=CHCH=CH2(g)转化为CH3C CCH3(g)的热化学方程式为CH2=CHCH=CH2(g)→CH3C≡CCH3(g)△H=+36.1kJ•mol-1.C C的键能为839.9kJ•mol-1.
(2)T1℃时,向10L恒容密闭容器中充入1.0molCH2=CHCH=CH2(g)和2.0molH2(g),发生反应Ⅰ.5min达到平衡,测得容器内CH3CH2CH2CH3(g)的物质的量为0.60mol.则:
①0~5min内,用H2表示的该反应速率v(H2)=0.024mol•L-1•min-1.
②T1℃时,该反应的平衡常数K=234.4(保留四位有效数字).
③下列事实能说明该反应达到平衡状态的是AD(填选项字母).
A.容器内气体压强不再改变
B.容器内气体密度不在改变
C.CH2=CHCH=CH2(g)和H2(g)的体积分数之比为1:2
D.容器内气体平均摩尔质量不再改变
(3)一定条件下,向密闭容器中冲入一定量的CH3C CCH3(g)和H2(g),发生反应Ⅱ,CH3C CCH3(g)的平衡转化率(α)与温度(T)和压强(P)的关系如图所示.
①P1>P2(填“>”“<”或“=”,下同)
②a、b两点的平衡常数:K(a)=K(b).
分析 (1)已知::Ⅰ.CH2=CHCH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)△H1=-236.6kJ•mol-1
Ⅱ.CH3C≡CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)△H=-272.7kJ•mol-1
由盖斯定律Ⅰ-Ⅱ可得CH2=CHCH=CH2(g)→CH3C≡CCH3(g);设C≡C的键能为x,结合C-C的键能为348kJ•mol-1;C=C的键能为612kJ•mol-1计算可得x;
(2)①根据v=$\frac{△c}{△t}$计算;
②计算各物质平衡浓度,根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比计算K;
③化学平衡时:正逆反应速率相等,各物质的含量保持不变,据此分析;
(3)①反应Ⅱ.CH3C≡CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)是个气体体积减小的反应,恒容相当于加压,根据压强对化学平衡的影响分析;
②温度不变,化学平衡常数K不变.
解答 解:(1)已知::Ⅰ.CH2=CHCH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)△H1=-236.6kJ•mol-1
Ⅱ.CH3C≡CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)△H=-272.7kJ•mol-1
由盖斯定律Ⅰ-Ⅱ可得CH2=CHCH=CH2(g)→CH3C≡CCH3(g)△H=+36.1kJ•mol-1;设C≡C的键能为x,C-C的键能为348kJ•mol-1;C=C的键能为612kJ•mol-1,反应前后的C-H相等,则x+348×2-612×2-348=-36.1,解得x=839.9kJ•mol-1;
故答案为:CH2=CHCH=CH2(g)→CH3C≡CCH3(g)△H=+36.1kJ•mol-1;839.9;
(2)①平衡时容器内CH3CH2CH2CH3(g)的物质的量为0.60mol,参加反应的氢气的物质的量为1.2mol,则0~5min,v(H2)=$\frac{1.2mol÷10L}{5min}$=0.024mol•L-1•min-1;
故答案为:0.024mol•L-1•min-1;
②得容器内CH3CH2CH2CH3(g)的物质的量为0.60mol,列三段式:
CH2=CHCH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)
c始:0.1 0.2 0
c转:0.06 0.12 0.06
c平:0.04 0.08 0.06
则此温度下化学平衡常数K=$\frac{0.06}{0.04×0.0{8}^{2}}$≈234.4;
故答案为:234.4;
③A.该反应左右两边均为气体且气体分子总数不等,容器内气体压强改变,不再改变时,反应达到平衡,故A正确;
B.容器内混合气体的总质量不变,恒容气体体积不变,则密度始终不变,故B错误;
C.CH2=CHCH=CH2(g)和H2(g)的体积分数之比为1:2并保持不变,故C错误;
D.容器内混合气体的总质量不变,气体总的物质的量减小,平均摩尔质量改变,不再改变时,反应达到平衡,故D正确;
故答案为:AD;
(3)①反应Ⅱ.CH3C≡CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)是个气体体积减小的反应,增大压强,平衡正向移动,②CH3C≡CCH3的转化率增大,从图可知,相同温度下,P1 的转化率大于的P2转化率,则P1>P2;
故答案为:>;
②a、b两点的温度相同,则化学平衡常数相等;
故答案为:=.
点评 本题考查了盖斯定律的应用、化学平衡状态的判断及有关计算、影响化学平衡的因素,题目难度中等,需要学生对基础知识的掌握,注意计算和单位.

 名校课堂系列答案
名校课堂系列答案
回答下列问题:
(1)反应I的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,氧化剂为SiO2(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)反应III和IV中尾气的用途为制取盐酸;反应IV的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.

| A. | 乙苯的同分异构体共有三种 | |
| B. | 可用Br2/CCl4鉴别乙苯和苯乙烯 | |
| C. | 乙苯和苯乙烯分子中均含有碳碳双健 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
| A. | 淀粉和油脂的水解都是高分子生成小分子的过程 | |
| B. | 2-甲基丙烷和异丁烷互为同系物 | |
| C. |  属于取代反应 属于取代反应 | |
| D. | C3H4Cl2的链状有机物的同分异构体有5种(不考虑立体异构) |
| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 | |
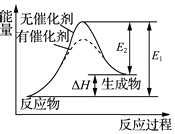
| C. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 | |
| D. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 |
| A. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| B. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| C. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值及SO2转化率不变 |
| A. | 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫 | |
| B. | 胆矾、漂白粉、硫酸钠、次氯酸、氨气 | |
| C. | 明矾、水煤气、盐酸.醋酸、铜 | |
| D. | 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇 |
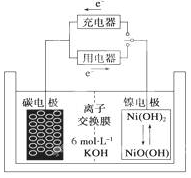 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向负极 | |
| B. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |



