题目内容
10.A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,F元祖的原子最外层电子数是电子层数的二倍,D是所在周期原子半径最大的主族元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:
(1)元素F在周期表中的位置第三周期 VIA族.
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+(用离子符号表示).
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X中所含化学键类型有①②④.(填数字编号)
①离子键 ②极性键 ③非极性键 ④配位键 ⑤氢键
(4)由A、B两种元素以原子个数比2:1形成的液态化合物Y含有18个电子,其水合物是一种二元弱碱,则Y的电子式为;由A、C、F三种元素形成的某化合物能与化合物Y形成一种酸式盐,常温下.1mol/L该酸式盐的pH为1,请写出该酸式盐的化学式N2H5HSO4.
(5)化合物Y和A、C形成的18电子分子可相互反应生成两种产物,其中一种产物是空气的主要成分,请写出反应的化学方程式:N2H4+2H2O2=N2↑+4H2O
(6)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
分析 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,F元素的原子最外层电子数是电子层数的二倍,F可能为C或S,根据“A与D同主族,C与F同主族”及原子序数大小可知F只能位于第三周期,为S元素,则C为O元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠、小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,据此进行解答.
解答 解:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,F元素的原子最外层电子数是电子层数的二倍,F可能为C或S,根据“A与D同主族,C与F同主族”及原子序数大小可知F只能位于第三周期,为S元素,则C为O元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠、小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,
(1)F是S元素,钠原子核外有3个电子层,最外层有6个电子,在元素周期表中的位置是第三周期第ⅥA族,
故答案为:第三周期 VIA族;
(2)电子层数越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是:S 2->O 2->Na+,
故答案为:S 2->O 2->Na+;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有:①离子键、②极性键、④配位键,
故答案为:①②④;
(4)A、B分别为H、N元素,由H、N两种元素以原子个数比2:1形成的液态化合物Y含有18个电子,该化合物的化学式为N2H4,该水合物是一种二元弱碱,则Y的结构简式为:NH2-NH2,电子式为 ;
;
由A、C、F三种元素形成的某化合物能与化合物Y(NH2-NH2)形成一种酸式盐,常温下1mol/L该酸式盐的pH为1,说明该酸式盐能够完全电离,则该酸式盐的化学式N2H5HSO4,
故答案为: ; N2H5HSO4;
; N2H5HSO4;
(5)化合物Y(NH2-NH2)和A、C形成的18电子分子可相互反应生成两种产物,其中一种产物是空气的主要成分,该产物为氮气,A、C形成的18电子分子为双氧水,则该反应的化学方程式:N2H4+2H2O2=N2↑+4H2O,
故答案为:N2H4+2H2O2=N2↑+4H2O;
(6)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,则E为Al,反应方程式为:2Al2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题综合考查学生分析能力、逻辑推理能力及对知识的迁移运用.

| A. | 聚乙烯是无毒高分子化合物,可用作食品包装 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| D. | 电子垃圾的回收利用,可减少对土壤和水源的污染 |
(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2=CH3OH+H2O.
(2)在120℃,如下容积固定的密闭容器中,当活塞被固定在整个装置的中间,X与Y按(1)在Ⅰ中进行反应:
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.

| A. | 乙苯的同分异构体共有三种 | |
| B. | 可用Br2/CCl4鉴别乙苯和苯乙烯 | |
| C. | 乙苯和苯乙烯分子中均含有碳碳双健 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 | |
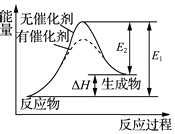
| C. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 | |
| D. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 |
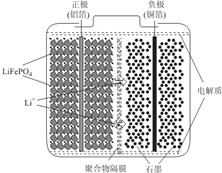 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.



