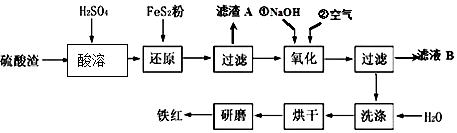
题目内容
11. 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
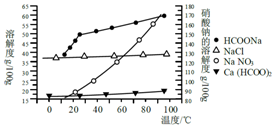
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
分析 Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率;
(2)温度较高时,双氧水易分解,甲醛易挥发;
(3)重金属离子与硫离子反应生成难溶的硫化物;
(4)搅拌是使反应物充分接触;甲酸钙水解显碱性,溶液为弱碱性能抑制其水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出.
解答 解:Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率,则加过量的过氧化氢能使甲醛充分氧化,提高甲醛的利用率和产品纯度;
故答案为:使甲醛充分氧化,提高甲醛的利用率和产品纯度;
(2)温度较高时,双氧水易分解,甲醛易挥发,则反应温度最好控制在30-70℃之间,温度不易过高,能防止H2O2分解和甲醛挥发;
故答案为:防止H2O2分解和甲醛挥发;
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,硫化钠与重金属离子结合生成硫化物,硫化物难溶于水,可以除去重金属离子;
故答案为:除去重金属离子;
(4)搅拌是使使反应物充分接触,使其反应完全,提高产率;甲酸根离子为弱酸根离子,则甲酸钙水解显弱碱性,调节溶液pH 7~8,溶液为弱碱性能抑制甲酸钙水解,故答案为:使反应物充分接触,提高产率;防止甲酸钙水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出;
则具体的步骤为:
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用;
步骤2.用稍过量硝酸溶解碳酸钙样品;
步骤3.用石灰水调整溶液pH=5;
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体,
故答案为:用稍过量硝酸溶解碳酸钙样品;用石灰水调整溶液pH=5;趁热过滤.
点评 本题是一道实验综合题,涉及实验操作目的、原理、步骤等有关问题,主要考查了物质的制备、除杂质、提高产率的方法、实验方案设计,题目难度中等,考查学生的实验探究能力.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2=CH3OH+H2O.
(2)在120℃,如下容积固定的密闭容器中,当活塞被固定在整个装置的中间,X与Y按(1)在Ⅰ中进行反应:
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.

| A. | 乙苯的同分异构体共有三种 | |
| B. | 可用Br2/CCl4鉴别乙苯和苯乙烯 | |
| C. | 乙苯和苯乙烯分子中均含有碳碳双健 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 | |
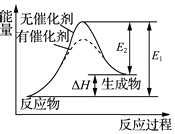
| C. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 | |
| D. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 |
| A. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| B. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| C. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值及SO2转化率不变 |
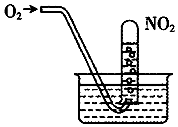
| A. | 当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3 | |
| B. | 当试管气体不是红棕色时,说明NO2全部转化为HNO3 | |
| C. | 水槽内的水改为稀盐酸,有利于吸收NO2 | |
| D. | 水槽内的水改为稀NaOH溶液,有利于吸收NO2 |
| A. | 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫 | |
| B. | 胆矾、漂白粉、硫酸钠、次氯酸、氨气 | |
| C. | 明矾、水煤气、盐酸.醋酸、铜 | |
| D. | 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇 |