题目内容
7.某溶液中含有SO32-、CO32-、HCO3-、SO42-、Na+,向该溶液中加入足量的Na2O2,假设溶液体积变化忽略不计,下列说法不正确的是( )| A. | 有气体生成 | |
| B. | Na+浓度基本不变 | |
| C. | HCO3-浓度减小而CO32-浓度增大 | |
| D. | SO32-发生反应的离子方程式为:SO32-+Na2O2+H2O=2Na++SO42-+2OH- |
分析 向该溶液中加入足量的Na2O2,与水反应生成NaOH,且过氧化钠具有强氧化性,与SO32-发生氧化还原反应,以此来解答.
解答 解:A.过氧化钠与水反应生成氧气,故A正确;
B.Na2O2与水反应生成NaOH,Na+浓度增大,故B错误;
C.NaOH与HCO3-反应,HCO3-浓度减小而CO32-浓度增大,故C正确;
D.过氧化钠具有强氧化性,与SO32-发生反应的离子方程式为:SO32-+Na2O2+H2O=2Na++SO42-+2OH-,故D正确;
故选B.
点评 本题考查离子的检验及物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.工业上可由乙苯生产苯乙烯:过程如图,下列说法正确的是( )

| A. | 乙苯的同分异构体共有三种 | |
| B. | 可用Br2/CCl4鉴别乙苯和苯乙烯 | |
| C. | 乙苯和苯乙烯分子中均含有碳碳双健 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
12.某小组设计如图所示装置,下列说法正确的是( )


| A. | 闭合K1,断开K2,可防止Fe发生吸氧腐蚀 | |
| B. | 闭合K1,断开K2,Cl-向石墨电极移动 | |
| C. | 闭合K2,断开K1,可用于制备家用消毒液(主要成分NaClO) | |
| D. | 闭合K2,断开K1,电解质溶液中Na+的浓度不变 |
19.下列说法正确的是( )
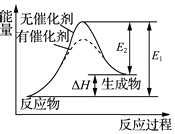

| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 | |
| C. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 | |
| D. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 |
16.如图,缓慢通入O2,用水吸收NO2(假设每次通入的O2能完全反应).下列说法正确的是( )
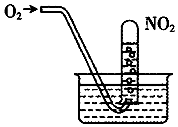

| A. | 当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3 | |
| B. | 当试管气体不是红棕色时,说明NO2全部转化为HNO3 | |
| C. | 水槽内的水改为稀盐酸,有利于吸收NO2 | |
| D. | 水槽内的水改为稀NaOH溶液,有利于吸收NO2 |
17.下列说法正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 由于2NO+2CO?2CO2+N2的△H<0,则该反应一定能自发进行 |
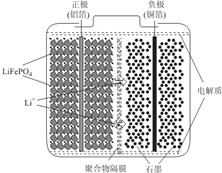 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.