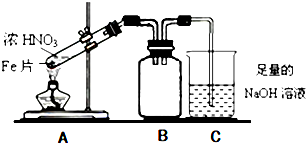
题目内容
13.用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol 的CuO和0.1molH2O后恰好恢复到电解前的浓度,则电解过程中阳极产生的气体在标准状况下的体积为( )| A. | 2.24L | B. | 3.36L | C. | 1.12L | D. | 4.48L |
分析 加入0.1molCu(OH)2后能使溶液恢复原状,阳极上氢氧根离子放电生成氧气,根据氧原子守恒计算生成氧气的物质的量,再根据V=nVm计算氧气体积.
解答 解:加入0.1molCu(OH)2后能使溶液恢复原状,阳极上氢氧根离子放电生成氧气,根据氧原子守恒得n(O2)=n[Cu(OH)2]=0.1mol,则氧气体积=0.1mol×22.4L/mol=2.24L,
故选A.
点评 本题以电解原理为载体考查了物质的量的计算,明确阳极上的产物再结合原子守恒进行计算即可,注意:阴极上生成氢气和铜,为易错点.

练习册系列答案
相关题目
3.用二甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示:
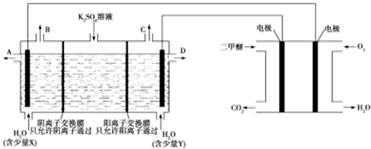
下列说法错误的是( )

下列说法错误的是( )
| A. | Y为KOH | |
| B. | A口导出的物质为H2SO4 | |
| C. | 二甲醚燃料电池的负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+ | |
| D. | 若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时,理论上C口收集到气体的体积为26.88L |
1.下列说法中正确的是( )
| A. | pH小于7的雨水称为酸雨 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | O3可用于游泳池的杀菌消毒 | |
| D. | 黄铜是纯铜,青铜是合金 |
5.已知2Fe3++2Br-=2Fe2++Br2,当把Cl2通入FeBr2溶液中时,下列离子方程式一定不正确的是( )
| A. | Cl2+2Br-=Br2+2Cl- | |
| B. | 4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- | |
| C. | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- | |
| D. | 2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
2.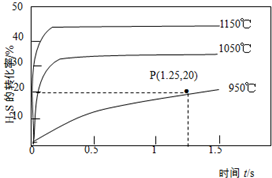 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)>v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
3.下列化学用语中,用来表示石油裂解产物丙烯的是( )
| A. | 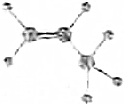 | B. | C3H6 | ||
| C. | 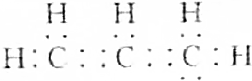 | D. | CH2═CHCH3 |
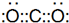 .
.