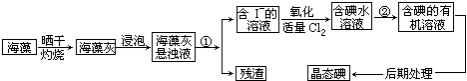
题目内容
17.下列表示对应化学反应的离子方程式正确的是( )| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
分析 A.次氯酸根离子具有强的氧化性,能够氧化氨气生成氮气,本身被还原为氯离子;
B.硝酸具有强的氧化性能够氧化亚硫酸根离子;
C.水解少量可逆;
D.二氧化硫过量反应生成亚硫酸氢根离子.
解答 解:A.加入NaClO将污水中的NH3氧化成N2,离子方程式::3ClO-+2NH3═N2↑+3Cl-+3H2O,故A正确;
B.向稀HNO3中滴加Na2SO3溶液,离子方程式:2NO3-+SO32-+2H+═SO42-+H2O+2NO↑,故B错误;
C.NaAlO2溶液中AlO2-的水解,离子方程式:AlO2-+2H2O?Al(OH)3+OH-,故C错误;
D.向Na2SiO3溶液中通入过量SO2,离子方程式:SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确离子反应实质是解题关键,侧重考查氧化还原反应离子方程式书写,题目难度中等.

练习册系列答案
相关题目
7.(1)氯碱工业是利用电解食盐水生产烧碱、氯气为基础的工业体系.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
为生产七水硫酸镁,设计了以下工艺流程:
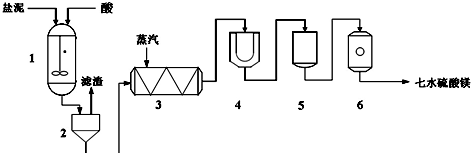
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
5.已知2Fe3++2Br-=2Fe2++Br2,当把Cl2通入FeBr2溶液中时,下列离子方程式一定不正确的是( )
| A. | Cl2+2Br-=Br2+2Cl- | |
| B. | 4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- | |
| C. | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- | |
| D. | 2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
2.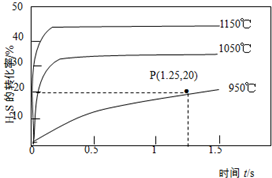 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)>v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
9.已知:常温下浓度为0.1mol/L的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| C. | 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后 | |
| D. | 向Na2CO3溶液中通入少量的HF气体,化学反应方程式为:Na2CO3+2HF═CO2+H2O+2NaF |
6.化学平衡常数(K)、电离常数(Ka,Kb)、溶度积常数(Ksp)等常数是表示判断物质性质的重要常数.下列关于这些常数的说法.不正确的是( )
| A. | 化学平衡常数的大小只与温度有关,与浓度、压强、催化剂无关 | |
| B. | 相同温度时,Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸弱 | |
| C. | 向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 当温度升高时,Ka(CH3COOH)变大 |
 的系统名称是3,4-二甲基-3-乙基己烷.
的系统名称是3,4-二甲基-3-乙基己烷. .
.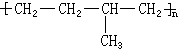 形成该高聚物的单体的结构简式分别为
形成该高聚物的单体的结构简式分别为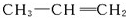 、
、 .
.