题目内容
10. 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:①CO(g)+2H2(g)═CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为BC.
A.加入某物质作催化剂 B.加入一定量CO
C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L.min);
若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,则a=5.4mol/L.
(3)催化反应室中总反应3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)的△H=-246.1kJ•mol-1.判断该反应易在低温(填“高温”或“低温”)下自发进行.
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如上图所示.b电极是正极,写出a电极上发生的电极反应式CH3OCH3+3H2O-12e-=2CO2+12H+.
分析 (1)若要增大反应①中H2的转化率,应改变条件使平衡正向移动,但不能只增大氢气的浓度,否则氢气转化率会降低;
(2)5min后达到平衡,CO的转化率为50%,则CO浓度减小1mol/L×50%=0.5mol/L,则:
CO(g)+2H2(g)═CH3OH(g)
起始(mol/L):1 2.4 0
变化(mol/L):0.5 1 0.5
平衡(mol/L):0.5 1.4 0.5
再根据v=$\frac{△c}{△t}$计算v(CO);根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,表示出平衡时各组分浓度,再结合平衡常数计算a的值;
(3)已知:①CO(g)+2H2(g)═CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.2kJ•mol-1
根据盖斯定律,①×2+②+③可得:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g);
正反应为气体物质的量减小的反应,则正反应为熵减的反应,△H-T△S<0反应自发进行;
(4)氢离子经过质子交换膜由左侧移向右侧,则a为负极,b为正极,负极发生还原反应,二甲醚在负极失去电子,生成二氧化碳与氢离子.
解答 解:(1)A.加入某物质作催化剂,可以加快反应速率,不影响平衡移动,H2的转化率不变,故A错误;
B.加入一定量CO,平衡正向移动,H2的转化率增大,故B正确;
C.正反应为放热反应,反应温度降低,平衡正向移动,H2的转化率增大,故C正确;
D.增大容器体积,压强减小,平衡逆向移动,H2的转化率减小.
故答案为:BC;
(2)5min后达到平衡,CO的转化率为50%,则CO浓度减小1mol/L×50%=0.5mol/L,则:
CO(g)+2H2(g)═CH3OH(g)
起始(mol/L):1 2.4 0
变化(mol/L):0.5 1 0.5
平衡(mol/L):0.5 1.4 0.5
5min内CO的平均反应速率v(CO)=$\frac{0.5mol/L}{5min}$=0.1mol/(L.min),
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×1.{4}^{2}}$=$\frac{1}{1.{4}^{2}}$
CO(g)+2H2(g)═CH3OH(g)
起始(mol/L):4 a 0
变化(mol/L):2 4 2
平衡(mol/L):2 a-4 2
则$\frac{2}{2×(a-4)^{2}}$=$\frac{1}{1.{4}^{2}}$,解得a=5.4,
故答案为:0.1mol/(L.min);5.4;
(3)已知:①CO(g)+2H2(g)═CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.2kJ•mol-1
根据盖斯定律,①×2+②+③可得:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g),
则△H=2×(-90.7kJ•mol-1)-23.5mol-1-41.2kJ•mol-1=-246.1kJ•mol-1,
正反应为气体物质的量减小的反应,则正反应为熵减的反应,△H-T△S<0反应自发进行,故该反应易在 低温下自发进行,
故答案为:-246.1kJ•mol-1;低温;
(4)氢离子经过质子交换膜由左侧移向右侧,则a为负极,b为正极,负极发生还原反应,二甲醚在负极失去电子,生成二氧化碳与氢离子,负极电极反应式为:CH3OCH3+3H2O-12e-=2CO2+12H+,
故答案为:正;CH3OCH3+3H2O-12e-=2CO2+12H+.
点评 本题比较综合,涉及化学平衡影响因素、化学平衡有关计算、反应热计算、原电池原理等,熟练掌握基础知识并灵活应用,掌握化学平衡常数的应用.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | pH小于7的雨水称为酸雨 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | O3可用于游泳池的杀菌消毒 | |
| D. | 黄铜是纯铜,青铜是合金 |
| A. | Cl2+2Br-=Br2+2Cl- | |
| B. | 4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- | |
| C. | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- | |
| D. | 2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
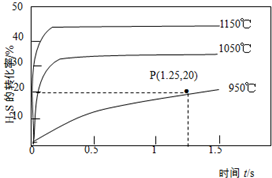 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)>v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |

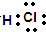 .
.

 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$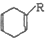
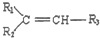 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$ +R3-COOH
+R3-COOH ,D的核磁共振氢谱共有3组峰.
,D的核磁共振氢谱共有3组峰.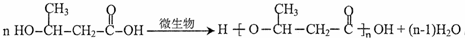 .
. (一种类似有机玻璃的塑料).第一步反应的化学方程式是
(一种类似有机玻璃的塑料).第一步反应的化学方程式是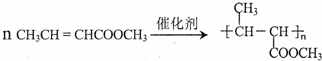 .
.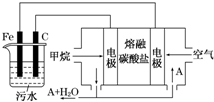 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.