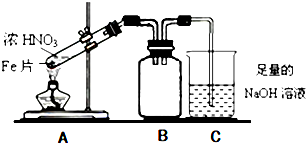
题目内容
16.已知A、B、C、D、E、F是短周期中的6种元素,它们的原子序数依次增大.A元素是周期表中半径最小的元素,B原子的最外层上有4个电子;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y;F的L层电子数等于K、M两个电子层上电子数之和(1)请写出元素符号:
AHBCCNDOENaFS
(2)画出F的阴离子的结构示意图
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为N2+3H2
 2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色
2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色(4)写出E在D的单质中点燃,生成固体Y化学方程式2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(5)将12gB单质在足量的D单质中燃烧,所得气体通入1L1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是Na+、HCO3-.(相对原子质量:C-12)
分析 A、B、C、D、E、F是短周期中的6种元素,它们的原子序数依次增大.A元素是周期表中半径最小的元素,则A为氢元素;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y,则D为O元素、E为Na,生成的Y为Na2O2;B原子的最外层上有4个电子,处于IVA族,原子序数小于氧,故B为碳元素;C的原子序数介于碳、氧之间,故C为N元素;F的L层电子数等于K、M两个电子层上电子数之和,则其M层电子数为8-2=6,故M为S元素,据此解答.
解答 解:A、B、C、D、E、F是短周期中的6种元素,它们的原子序数依次增大.A元素是周期表中半径最小的元素,则A为氢元素;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y,则D为O元素、E为Na,生成的Y为Na2O2;B原子的最外层上有4个电子,处于IVA族,原子序数小于氧,故B为碳元素;C的原子序数介于碳、氧之间,故C为N元素;F的L层电子数等于K、M两个电子层上电子数之和,则其M层电子数为8-2=6,故M为S元素.
(1)由上述分析可知,A、B、C、D、E、F的元素符号分别为H、C、N、O、Na、S,
故答案为:H;C;N;O;Na;S;
(2)F的阴离子为S2-,离子的结构示意图为: ,
,
故答案为: ;
;
(3)氢气与氮气在一定条件下反应生成氨气,该反应的化学方程式为:N2+3H2 2NH3,氨气的水溶液呈碱性,向氨气的水溶液中滴入酚酞溶液,会观察到溶液变红色,
2NH3,氨气的水溶液呈碱性,向氨气的水溶液中滴入酚酞溶液,会观察到溶液变红色,
故答案为:N2+3H2 2NH3;溶液变红色;
2NH3;溶液变红色;
(4)钠在氧气中燃烧生成过氧化钠,化学反应方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(5)12g碳单质的物质的量是$\frac{12g}{12g/mol}$=1mol,完全燃烧生成CO2为1mol,NaOH的物质的量为1L×1mol/L=1mol,恰好发生反应CO2+NaOH=NaHCO3,溶液中大量存在的离子为Na+、HCO3-,
故答案为:Na+、HCO3-.
点评 本题考查结构性质与位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | x=1 | |
| B. | B的转化率为20% | |
| C. | 平衡时A的浓度为1.50mol/L | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强与反应前相等 |
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
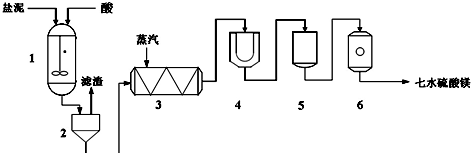
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
| A. | H2和Cl2 | B. | Cu和 O2 | C. | H2和Na | D. | Cu 和 H2 |
| A. | pH小于7的雨水称为酸雨 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | O3可用于游泳池的杀菌消毒 | |
| D. | 黄铜是纯铜,青铜是合金 |
| A. | Cl2+2Br-=Br2+2Cl- | |
| B. | 4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- | |
| C. | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- | |
| D. | 2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
| A. | 化学平衡常数的大小只与温度有关,与浓度、压强、催化剂无关 | |
| B. | 相同温度时,Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸弱 | |
| C. | 向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 当温度升高时,Ka(CH3COOH)变大 |
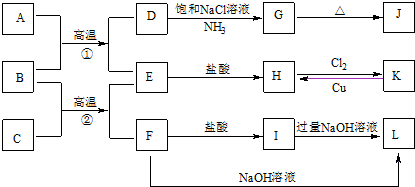
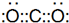 .
.