题目内容
5.如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )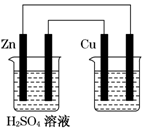
| A. | 铜在原电池中作负极,在电镀池中作阳极 | |
| B. | 原电池溶液增加的质量比电镀池阴极增加的质量大 | |
| C. | 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol | |
| D. | 电镀池中的电解质溶液可用ZnSO4溶液 |
分析 A、根据原电池活泼性强的为负极,电镀池镀层金属作阳极判断;
B、根据电池中的反应既铜锌原电池的反应为:Zn+2H+=Zn2++H2↑,电镀池阴极反应为Cu2++2e-=Cu判断;
C、根据原电池中负极为:Zn-2e-=Zn2+计算;
D、电镀池中的电解质溶液应为含镀层金属的盐溶液.
解答 解:A、活泼性强的为负极,所以在铜锌原电池,Zn为负极,镀层金属作阳极,则在电镀池中Cu作阳极,故A错误;
B、铜锌原电池的反应为:Zn+2H+=Zn2++H2↑,若1molZn反应溶液的质量增加为65-2=63g,电镀池阴极析出Cu增加64g,所以原电池溶液增加的质量比电镀池阴极增加的质量小,故B错误;
C、原电池中负极为:Zn-2e-=Zn2+,锌棒每减少0.65g即0.01mol,导线上转移的电子为0.02mol,故C正确;
D、电镀池中的电解质溶液应为含镀层金属的盐溶液,所以铁棒上电镀铜,则可用CuSO4溶液,不可用ZnSO4溶液,故D错误.
故选C.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
11.下列说法正确的是( )
| A. | 1 mol蔗糖可以水解生成2mo1葡萄糖 | |
| B. | 食用花生油能发生水解反应 | |
| C. | C2H4C12、C5H12均只有两种同分异构体 | |
| D. | 苯乙烯分子内共平面的碳原子数最多为7个 |
16.下列物质属于单质的是( )
| A. | 干冰 | B. | 石墨 | C. | 青铜 | D. | 碳素墨水 |
13.下列说法正确的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑是水作还原剂的氧化还原反应 | |
| B. | 1mol Na2O2固体中含离子总数为4NA | |
| C. | 用灼烧的方法除去Na2CO3中的NaHCO3 | |
| D. | NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
20.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.下列说法错误的是( )
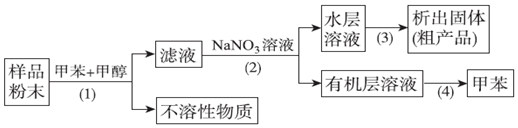

| A. | 步骤(1)需要过滤装置 | |
| B. | 步骤(3)需要用到蒸发皿 | |
| C. | 活性天然产物易溶于有机溶剂难溶于水 | |
| D. | 步骤(4)是利用物质沸点差异进行分离的 |
10.下列叙述正确的是( )
| A. | NaCl溶液在电流作用下电离成Na+和Cl- | |
| B. | 溶于水后能够电离出H+的化合物都是酸 | |
| C. | 氯化氢溶于水形成的溶液能够导电,所以氯化氢是电解质 | |
| D. | CO2溶于水形成的溶液能够导电,所以CO2是电解质 |
17.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 两试管各加入5ml 0.1mol/L Na2S2O3溶液,同时分别滴入5ml 0.1mol/L硫酸和盐酸 | 两支试管同时变浑浊 | 其它条件不变时,Cl-一定有催化效果 |
| C | A1箔插入稀HNO3中 | 无现象 | A1箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
14.下列离子方程式书写正确的是( )
| A. | 碳酸氢钠溶液中加稀盐酸入:HCO3-+H+═CO2↑+H2O | |
| B. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |