题目内容
14.下列离子方程式书写正确的是( )| A. | 碳酸氢钠溶液中加稀盐酸入:HCO3-+H+═CO2↑+H2O | |
| B. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
分析 A.二者反应生成氯化钠、水和二氧化碳;
B.碳酸钡为沉淀,应保留化学式;
C.电荷不守恒;
D.不符合反应客观事实.
解答 解:A.碳酸氢钠溶液中加稀盐酸入,离子方程式:HCO3-+H+═CO2↑+H2O,故A正确;
B.碳酸钡和稀硝酸反应,离子方程式:BaCO3+2H+═CO2↑+H2O+Ba2+,故B错误;
C.铜片插入硝酸银溶液,离子方程式:Cu+2Ag+═Cu2++2Ag,故C错误;
D.金属铁放入稀硫酸中反应生成硫酸亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,侧重考查复分解反应、氧化还原反应离子方程式,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
4.下列离子方程式正确的是( )
| A. | MgSO4与Ba(OH)2溶液反应:SO42-+Ba2+=Ba SO4↓ | |
| B. | CuSO4溶液吸收H2S气体:Cu2++S2-=CuS↓ | |
| C. | AlCl3 溶液中加入过量的浓氨水:Al3++4NH3•H2O=A1O2-+4NH4++2H2O | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O |
5.如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
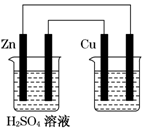

| A. | 铜在原电池中作负极,在电镀池中作阳极 | |
| B. | 原电池溶液增加的质量比电镀池阴极增加的质量大 | |
| C. | 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol | |
| D. | 电镀池中的电解质溶液可用ZnSO4溶液 |
2.有一含有Na+、Mg2+、Cl-、SO42-的溶液,已知Na+、Mg2+、Cl-的个数之比为3:7:9,则Cl-与SO42-的个数比为( )
| A. | 9:4 | B. | 4:9 | C. | 2:1 | D. | 1:2 |
9.将钠投入下列溶液中,反应的剧烈程度由强到弱的是( )
①水 ②乙醇 ③0.5mol•L-1盐酸 ④0.1mol•L-1 FeCl3溶液.
①水 ②乙醇 ③0.5mol•L-1盐酸 ④0.1mol•L-1 FeCl3溶液.
| A. | ④③②① | B. | ④③①② | C. | ③④①② | D. | ①③④② |
19.向二氯化铂的HCl溶液中通入乙烯气体,再加入KCl可得K[Pt(C2H4)Cl3]•H2O (蔡氏盐),下列有关化学用语表示正确的是( )
| A. | KCl的电子式: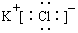 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 中子数为117,质子数为78 的铂原子:${\;}_{117}^{195}Pt$ | |
| D. | K+的结构示意图: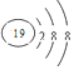 |
6.下列说法正确的是( )
| A. | 凡能导电的物质一定是单质 | |
| B. | 金属单质都能与稀硫酸发生置换反应 | |
| C. | 在化学反应中,金属单质失电子,常作还原剂 | |
| D. | 活泼金属都能从盐溶液中置换出较不活泼的金属 |
3.下列离子在水溶液中,一定不能做氧化剂的是( )
| A. | MnO4- | B. | H+ | C. | SO42- | D. | NO3- |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L空气中O2、N2分子总数目为NA | |
| B. | 0.1 mol羟基中所含电子数目为NA | |
| C. | 28 g乙烯、丙烯混合气体中所含原子数为6NA | |
| D. | 5.6 g铁与硝酸完全反应时转移的电子数目为0.3NA |