题目内容
20.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.下列说法错误的是( )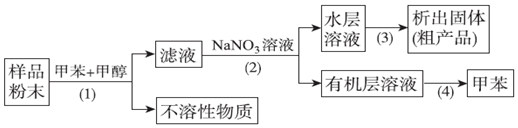
| A. | 步骤(1)需要过滤装置 | |
| B. | 步骤(3)需要用到蒸发皿 | |
| C. | 活性天然产物易溶于有机溶剂难溶于水 | |
| D. | 步骤(4)是利用物质沸点差异进行分离的 |
分析 步骤(1)是分离固液混合物,其操作为过滤,步骤(2)分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;步骤(3)是从溶液中得到固体,操作为蒸发,需要蒸发皿;步骤(4)是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,以此来解答.
解答 解:A.步骤(1)是分离固液混合物,其操作为过滤,需要过滤装置,故A正确;
B.步骤(3)是从溶液中得到固体,操作为蒸发,需要蒸发皿,而不用坩埚,故B正确;
C.由步骤(3)可知,蒸发水溶液得到粗产品,则该有机物能溶于水,故C错误;
D.步骤(4)是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,需要蒸馏装置,故D正确;
故选C.
点评 本题考查物质分离、提纯实验方案的设计,为高频考点,把握流程中物质的性质及分离方法是解答本题的关键,注重实验操作和分离方法的考查,题目难度不大.

练习册系列答案
相关题目
6.下列化合物进行硝化时,反应的活性最大的是( )
| A. | 甲苯 | B. | 间二甲苯 | C. | 对二甲苯 | D. | 苯 |
5.如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
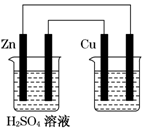

| A. | 铜在原电池中作负极,在电镀池中作阳极 | |
| B. | 原电池溶液增加的质量比电镀池阴极增加的质量大 | |
| C. | 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol | |
| D. | 电镀池中的电解质溶液可用ZnSO4溶液 |
12.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、SO42-、Cl-、NH4+ |
9.将钠投入下列溶液中,反应的剧烈程度由强到弱的是( )
①水 ②乙醇 ③0.5mol•L-1盐酸 ④0.1mol•L-1 FeCl3溶液.
①水 ②乙醇 ③0.5mol•L-1盐酸 ④0.1mol•L-1 FeCl3溶液.
| A. | ④③②① | B. | ④③①② | C. | ③④①② | D. | ①③④② |
10.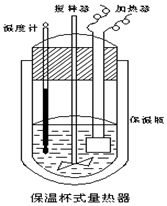 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )| A. | 该实验测得的中和热△H为-53.3kJ•mol-1 | |
| B. | 若量热计的保温瓶绝热效果不好,则所测得的△H偏大 | |
| C. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| D. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 |