题目内容
13.下列说法正确的是( )| A. | 2Na2O2+2H2O═4NaOH+O2↑是水作还原剂的氧化还原反应 | |
| B. | 1mol Na2O2固体中含离子总数为4NA | |
| C. | 用灼烧的方法除去Na2CO3中的NaHCO3 | |
| D. | NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
分析 A.2Na2O2+2H2O=4NaOH+O2↑,O元素化合价由-1变为-2和0价;
B.过氧化钠化学式是由1个过氧根离子和2个钠离子构成,所以其阴阳离子个数之比为1:2,据此计算离子总数;
C.碳酸氢钠加热分解生成碳酸钠;
D.NaHCO3溶液中加入稀盐酸:HCO3-+H+═CO2↑+H2O.
解答 解:A.2Na2O2+2H2O=4NaOH+O2↑,O元素化合价由-1变为-2和0价,Na2O2既是氧化剂也是还原剂,水既不是氧化剂也不是还原剂,故A错误;
B.过氧化钠化学式是由1个过氧根离子和2个钠离子构成,所以其阴阳离子个数之比为1:2,则1molNa2O2固体中含有离子总数为3NA,故B错误;
C.碳酸氢钠加热分解生成碳酸钠,而碳酸钠加热不分解,所以用灼烧的方法除去Na2CO3中的NaHCO3,故C正确;
D.NaHCO3溶液中加入稀盐酸:HCO3-+H+═CO2↑+H2O,故D错误;
故选C.
点评 本题考查钠及其化合物的性质,明确物质的组成以及反应的本质,熟练掌握氧化还原反应的特征即可解答,难度不大.

练习册系列答案
相关题目
19.在给定的条件下,下列选项所示的物质间转化均能一步实现的是( )
| A. | SiO2$→_{△}^{NaOH(aq)}$Na2SiO3$\stackrel{CO_{2}}{→}$H2SiO3 | |
| B. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3 | |
| C. | NH3$→_{催化剂/△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg |
4.下列离子方程式正确的是( )
| A. | MgSO4与Ba(OH)2溶液反应:SO42-+Ba2+=Ba SO4↓ | |
| B. | CuSO4溶液吸收H2S气体:Cu2++S2-=CuS↓ | |
| C. | AlCl3 溶液中加入过量的浓氨水:Al3++4NH3•H2O=A1O2-+4NH4++2H2O | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O |
18.化学与人类生产、生活、社会可持续发展密切相关,下列说法错误的是( )
| A. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硅胶 | |
| B. | “天宫一号”中使用的碳纤维,是一种新型无机非金属材料 | |
| C. | 二氧化硅可用于光纤通信、单晶硅可用于光电转换 | |
| D. | 淀粉、油脂和蛋白质都是高分子化合物 |
5.如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
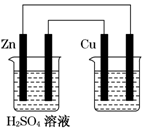

| A. | 铜在原电池中作负极,在电镀池中作阳极 | |
| B. | 原电池溶液增加的质量比电镀池阴极增加的质量大 | |
| C. | 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol | |
| D. | 电镀池中的电解质溶液可用ZnSO4溶液 |
2.有一含有Na+、Mg2+、Cl-、SO42-的溶液,已知Na+、Mg2+、Cl-的个数之比为3:7:9,则Cl-与SO42-的个数比为( )
| A. | 9:4 | B. | 4:9 | C. | 2:1 | D. | 1:2 |
3.下列离子在水溶液中,一定不能做氧化剂的是( )
| A. | MnO4- | B. | H+ | C. | SO42- | D. | NO3- |