题目内容
1. 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
①5min内该反应的平均速率υ (NO)=0.2mol•L-1•min-1;在T℃时,该反应的平衡常数K=1.25.
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是cd(填序号).
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
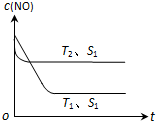
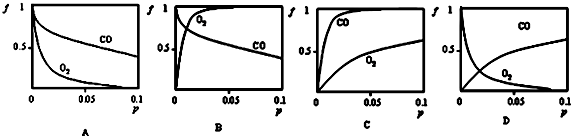
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H<0 (选填“>”或“<”).
②若催化剂的表面积S1>S2,在图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线
 .
.
分析 (1)5min时反应达到平衡状态,此时容器中NO的物质的量是5mol,则
浓度 N2(g)+O2(g)?2NO(g),
开始 1.3 1.5 0
转化 0.5 0.5 1
平衡 0.8 1 1
①结合v=$\frac{△c}{△t}$、K为生成物浓度幂之积与反应物浓度幂之积的比计算;
②结合平衡前速率、物质的量均在变化分析;
(2)①由图可知,T2先达到平衡,温度高,且对应NO的浓度高,即升高温度平衡逆向移动;
②若催化剂的表面积S1>S2,平衡时浓度不变,但S1对应的速率大,时间短.
解答 解:(1)5min时反应达到平衡状态,此时容器中NO的物质的量是5mol,则
浓度 N2(g)+O2(g)?2NO(g),
开始 1.3 1.5 0
转化 0.5 0.5 1
平衡 0.8 1 1
①5min内该反应的平均速率υ (NO)=$\frac{1mol/L}{5min}$=0.2 mol•L-1•min-1,K=$\frac{{1}^{2}}{0.8×1}$=1.25,故答案为:0.2 mol•L-1•min-1;1.25;
②a.混合气体质量、体积不变,则密度始终不变,故不选;
b.该反应为气体物质的量不变的反应,混合气体的压强始终不变,故不选;
c.正反应速率在平衡前一直减小,达到平衡时不变,故选;
d.单位时间内,N2和NO的消耗量之比一直在变化,不变时达到平衡,故选;
故答案为:c d;
(2)①由图可知,T2先达到平衡,温度高,且对应NO的浓度高,即升高温度平衡逆向移动,则该反应的△H<0,故答案为:<;
②若催化剂的表面积S1>S2,平衡时浓度不变,但S1对应的速率大,时间短,画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为 ,故答案为:
,故答案为: .
.
点评 本题考查化学平衡计算,为高频考点,把握图中浓度的变化、速率及K的计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意平衡三段法的应用,题目难度不大.

(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO (g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
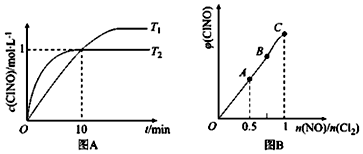
由图A可判断T1、T2温度的速率:v1<v2(“>”“<”或“=”),该反应的△H<0 (“>”“<”或“=”).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),发生反应2NO(g)+C12(g)?2C1NO(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点(“A、B、C”).
(1)肼易溶于水,性质与氨相似,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)肼(N2H4)与N2O4的反应为:2N2H4 (1)+N2O4 (1)=3N2(g)+4H2O(1)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如下:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
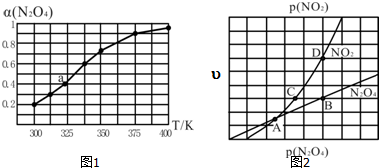
(3)N2O4与NO2之间存在反应N2O4(g)═2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),理由为温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应,△H>0,若要提高N2O4的转化率,除改变反应温度外,其他措施有减小体系压强(或移出NO2等)(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:υ(N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中kl、k2是与反应温度有关的常数.相应的速率一压强关系如图2所示,一定温度下,kl、k2与平衡常数Kp的关系是kl=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点,理由是满足平衡条件υ(NO2)=2υ(N2O4).

 反应类型加聚反应
反应类型加聚反应 反应类型取代反应
反应类型取代反应 反应类型取代反应
反应类型取代反应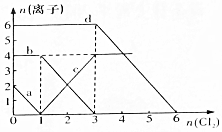 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答: