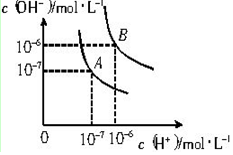
题目内容
11.雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等.化学在解决雾霾污染中有着重要的作用.(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol -1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1.
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K=1.8.
(2)如图1是一种用NH3脱除烟气中NO的原理.
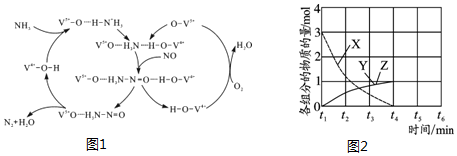
①该脱硝原理中,NO最终转化为H2O和N2(填化学式).
②当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为11.2L.
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径.在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示,写出NO分解的化学方程式:3NO$\frac{\underline{\;高压\;}}{\;}$N2O+NO2.
分析 (1)2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1①,2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1 ②,将方程式$\frac{①-②}{2}$得:NO2(g)+SO2(g)?SO3(g)+NO(g)反应热,计算平衡时各物质的浓度,可K=$\frac{C(S{O}_{3})C(NO)}{C(N{O}_{2})C(S{O}_{2})}$计算平衡常数;
(2)由图2可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算;
(3)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物书写方程式.
解答 解:(1)2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1①
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1 ②
将方程式$\frac{①-②}{2}$得:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=$\frac{-196.6KJ/mol-(-113.0KJ/mol)}{2}$=-41.8kJ/mol,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:5,即(a-x):(2a-x)=1:5,故x=$\frac{3}{4}$a,故平衡常数K=$\frac{C(S{O}_{3})C(NO)}{C(N{O}_{2})C(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{9}{16}}{\frac{1}{4}×\frac{5}{4}}$=1.8,
故答案为:-41.8;1.8;
(2)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O,
故答案为:N2;
②反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,1molNH3转化为N2失去3mol电子,0.5molO2得到2mol电子,则NO转化为N2得到的电子为1mol,所以NO的物质的量为0.5mol,其体积为22.4L/mol×0.5mol=11.2L,
故答案为:11.2;
(3)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,所以方程式为3NO $\frac{\underline{\;高压\;}}{\;}$N2O+NO2,
故答案为:3NO $\frac{\underline{\;高压\;}}{\;}$N2O+NO2.
点评 本题考查了盖斯定律的应用、平衡常数的计算、氧化还原反应化学方程式的书写及其计算、图象的分析与应用等,为高考常见题型,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.

| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
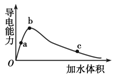 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
| A. | 醋酸的电离程度:a<b<c | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
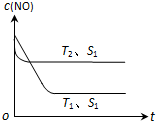 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务. .
.