题目内容
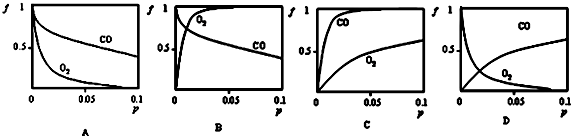
16.肌红蛋白(Mb)与血红蛋白(Hb)的主要功能为输送氧气与排出二氧化碳.肌红蛋白(Mb)可以与小分子X(如氧气或一氧化碳)结合.反应方程式:Mb(aq)+X(g)?MbX(aq)(1)在常温下,肌红蛋白与CO 结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),下列哪个图最能代表结合率(f)与此两种气体压力(p)的关系c.
(2)①通常用p 表示分子X 的压力,p0表示标准状态大气压.若X 分子的平衡浓度为$\frac{p}{{p}_{0}}$,上述反应的平衡常数为K,请用p、p0和K 表示吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例$\frac{pK}{pK+{p}_{0}}$.
②下图表示37℃下反应“Mb(aq)+O2(g)?MbO2(aq)”肌红蛋白与氧气的结合度(α)与氧分压p(O2)的关系,p0取101kPa.据图可以计算出37℃时上述反应的正反应平衡常数Kp=2.00.

分析 (1)Mb(aq)+X(g)?MbX(aq),增大压强,平衡正向移动,因此无论是CO还是O2,随着压强的增大,结合率(f)都是逐渐增大;肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),说明肌红蛋白与CO的结合能力比其与O2的结合能力强;
(2)①设平衡时吸附小分子的肌红蛋白(MbX)的浓度为[MbX],肌红蛋白(Mb)的浓度为[Mb],根据K的概念代入表达式;
②令Mb起始浓度为1,根据三段式:
Mb(aq)+O2(g)?MbO2(aq)
起始:1 0
转化:α α
平衡:1-α α
K=$\frac{c(Mb{O}_{2})}{c(Mb)•P({O}_{2})}$=$\frac{α}{(1-α)P({O}_{2})}$,根据图2,p(O2)=2.0kPa,α=80%,代入计算.
解答 解:(1)对于Mb(aq)+X(g)?MbX(aq),增大压强,平衡正向移动,因此无论是CO还是O2,随着压强的增大,结合率(f)都是逐渐增大.在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),说明肌红蛋白与CO的结合能力比其与O2的结合能力强,所以相同压强条件下,肌红蛋白与CO的结合率(f)更大,因此C图象符合,
故答案为:C;
(2)①设平衡时吸附小分子的肌红蛋白(MbX)的浓度为[MbX],肌红蛋白(Mb)的浓度为[Mb],则对于Mb(aq)+X(g)?MbX(aq),平衡常数K=$\frac{[MbX]}{[Mb]•\frac{p}{{p}_{0}}}$,所以[Mb]=$\frac{[MbX]}{K•\frac{p}{{p}_{0}}}$,所以吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例为$\frac{[MbX]}{[MbX]+[Mb]}$,将[Mb]代入整理可得,比例为$\frac{pK}{pK+{p}_{0}}$;
故答案为:$\frac{pK}{pK+{p}_{0}}$;
②令Mb起始浓度为1,根据三段式:
Mb(aq)+O2(g)?MbO2(aq)
起始:1 0
转化:α α
平衡:1-α α
K=$\frac{c(Mb{O}_{2})}{c(Mb)•P({O}_{2})}$=$\frac{α}{(1-α)P({O}_{2})}$,根据图2,p(O2)=2.0kPa,α=80%,K=$\frac{0.8}{(1-0.8)×2}$=2.00;
故答案为:2.00.
点评 本题考察化学反应原理的载体一改工业合成的惯例,采用人体中气体分子与蛋白结合的平衡模型,非常新颖.本题的思维含量很高,计算量也不小,特别是第(2)题要求对平衡常数的运算式熟练掌握,并且引入平衡分压概念,适当拓展,全面思考的能力.此题难度很大.

(1)工业上利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)???CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
现在采用新工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),该反应的△H=(2a+b+c)kJ•mol-1,平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$.
(2)增大压强,CH3OCH3的产率增大(填“增大”“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气的组成、压强、反应时间等因素不变,实验结果如图.CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;.

(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH的转化率α(CH3OH)=97.5%.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
(2)最高价氧化物的水化物碱性最强的是KOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF,
(4)在这些元素中(除I外),原子半径最大的是K,原子半径最小的是F
(5)D和K组成化合物的电子式
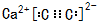 ,
,(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+2H2O.
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |
(1)25℃时,用合成气制备甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(l)△H=-128.1kJ?mol-1.
(2)工业上可利用甲烷制造合成气,发生的反应为CH4(g)+CO2(g)?2CO(g)+2H2(g);某温度下,向容积为4L的恒容密闭容器中通入6mol CO2和6mol CH4发生上述反应,5min后在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5min内的平均反应速率v(CO)=0.2mol?L-1?min-1;在相同温度下,将上述反应改在起始容积为4L的恒压密闭容器内进行,则到达平衡的时间大于(填“大于”或“小于”或“等于”)5min.
(3)反应CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ?mol-1为一碳化学在有机合成方面的重要应用.温度和压强对该反应的影响如图所示:

①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸(HCOOCH3)甲酯应选择的压强是b(填下列序号字母);
a.3.5×106Pa b.4.0×106 Pa c.5.0×106 Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低.
 .
.
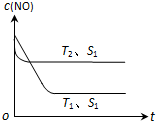 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务. .
.