��Ŀ����
9�����亽���������£�N2H4����N2O4��ȼ������ȼ����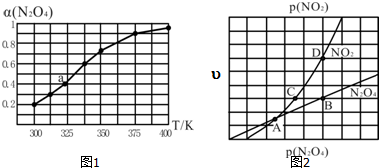
��1����������ˮ�������백���ƣ��õ��뷽��ʽ��ʾ�µ�ˮ��Һ�Լ��Ե�ԭ��N2H4+H2O?N2H+5+OH-��
��2���£�N2H4����N2O4�ķ�ӦΪ��2N2H4 ��1��+N2O4 ��1��=3N2��g��+4H2O��1����H=-1225kJ•mol-1
��֪��Ӧ��صĻ�ѧ�������������£�
| ��ѧ�� | N-H | N-N | N��N | O-H |
| E/��kJ•mol-1�� | 390 | 190 | 946 | 460 |
��3��N2O4��NO2֮����ڷ�ӦN2O4��g���T2NO2��g������һ������N2O4��������ܱ������У������ƽ��ת����[����N2O4��]���¶ȱ仯��ͼ1��ʾ��
����ͼ�Ʋ�÷�Ӧ��H��0�������������������Ϊ�¶����ߣ�����N2O4�����ӣ�˵��ƽ�����ƣ��÷�ӦΪ���ȷ�Ӧ����H��0����Ҫ���N2O4��ת���ʣ����ı䷴Ӧ�¶��⣬������ʩ�м�С��ϵѹǿ�����Ƴ�NO2�ȣ���Ҫ��д��һ������
��ͼ��a���Ӧ�¶��£���֪N2O4����ʼѹǿp0Ϊ108kPa����ʽ������¶��·�Ӧ��ƽ�ⳣ��Kp=115.2����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
����һ�������£��÷�ӦN2O4��NO2����������������ѹǿ����ڹ�ϵ���ԣ�N2O4��=k1p��N2O4�����ԣ�NO2��=k2p2��NO2��������kl��k2���뷴Ӧ�¶��йصij�������Ӧ������һѹǿ��ϵ��ͼ2��ʾ��һ���¶��£�kl��k2��ƽ�ⳣ��Kp�Ĺ�ϵ��kl=$\frac{1}{2}$K2��Kp����ͼ����ĵ��У��ܱ�ʾ��Ӧ�ﵽƽ��״̬�ĵ�ΪB����D�㣬����������ƽ�������ԣ�NO2��=2�ԣ�N2O4����
���� ��1��N2H4���H2O�����������ʹ��Һ�ʼ��ԣ�
��2����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ�
��3���������¶�ƽ�������ȷ����ƶ�����С��ϵѹǿ���Ƴ�NO2��ʹƽ�������ƶ���
�ڻ�ѧƽ�ⳣ��K=$\frac{�������ѹ��֮��}{��Ӧ���ѹ��֮��}$��
�ۻ�ѧƽ�ⳣ��Kp=[p��NO2��]2��p��N2O4�������ߵķ�Ӧ����֮�ȵ����������֮�ȣ�����ƽ�������ԣ�NO2��=2�ԣ�N2O4����Ϊƽ��㣮
��� �⣺��1����������ˮ�������백���Ƶ�������������OH-�������ӣ����뷽��ʽΪN2H4+H2O?N2H+5+OH-��
�ʴ�Ϊ��N2H4+H2O?N2H+5+OH-��
��2����1mol N2O4��1����ȫ�ֽ����Ӧ��ԭ��ʱ��Ҫ���յ�����QKJ����
190kJ/mol��2+390kJ/mol��8+QkJ/mol-946kJ/mol��3-460kJ/mol��8=-1225 kJ/mol��
���Q=1793��
�ʴ�Ϊ��1793kJ��
��3���ٸ���ͼ֪�������¶�ת�������������¶�ƽ�������ȷ����ƶ���������Ӧ�����ȷ�Ӧ����Ҫ���N2O4ת���ʣ����ı䷴Ӧ�¶��⣬������ʩ�м�С��ϵѹǿ���Ƴ�NO2��
�ʴ�Ϊ������ �¶����ߣ�����N2O4�����ӣ�˵��ƽ�����ƣ��÷�ӦΪ���ȷ�Ӧ����H��0����С��ϵѹǿ�����Ƴ�NO2�ȣ���
��������������ת������0.4����ԭ���������������ʵ���Ϊxmol��ת�������ʵ���Ϊ0.8xmol��������������ʵ���=��x-0.4x+0.8x��mol=1.4xmol����ͬ�����£������ѹǿ֮�ȵ��������ʵ���֮�ȣ����Է�Ӧ��ѹǿ=$\frac{108KPa}{xmol}$=151.2KPa��
�����������ķ�ѹ=151.2KPa��$\frac{0.6xmol}{1.4xmol}$=64.8KPa��
���������ķ�ѹ=151.2KPa��$\frac{0.8xmol}{1.4xmol}$=86.4KPa��
��ѧƽ�ⳣ��K=$\frac{�������ѹ��֮��}{��Ӧ���ѹ��֮��}$=$\frac{86��{4}^{2}}{64.8}$=115.2��
�ʴ�Ϊ��115.2��
�ۻ�ѧƽ�ⳣ��Kp=[p��NO2��]2��p��N2O4�������ߵķ�Ӧ����֮�ȵ����������֮�ȣ�
���Ԧԣ�NO2�����ԣ�N2O4��=k2[p��NO2��]2��k1•p��N2O4��=2��1��
��ѧƽ�ⳣ��Kp=[p��NO2��]2��p��N2O4����
��K1=$\frac{1}{2}$K2��Kp��
����ƽ�������ԣ�NO2��=2�ԣ�N2O4����Ϊƽ��㣬BD���ѹǿ֮�ȵ����䷴Ӧ����֮��Ϊ1��2������BDΪƽ��㣬
�ʴ�Ϊ��$\frac{1}{2}$K2��Kp��B����D�㣻����ƽ�������ԣ�NO2��=2�ԣ�N2O4����
���� ���⿼�黯ѧƽ���йؼ��㡢��ѧƽ��Ӱ���ƶ�����Ӧ�ȼ���ȣ��Ƕ�ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�

| A�� | AgCl�ڱ���NaCl��Һ�е�Ksp���ڴ�ˮ�е�KspС | |
| B�� | ��AgCl������Һ�еμ�Ũ��ˮ�������ܽ⣬˵��AgCl���ܽ�ƽ�������ƶ� | |
| C�� | ��0.001 mol•L-1AgNO3��Һ����0.001 mol•L-1��KCl��0.001 mol•L-1��K2CrO4��Һ���Ȳ���Ag2CrO4���� | |
| D�� | ��AgCl������Һ�м���NaBr��Һ����ɫ����ת��Ϊ����ɫ��˵��Ksp��AgCl����Ksp��AgBr�� |
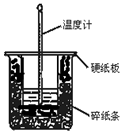 50mL 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش������⣺
50mL 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش������⣺
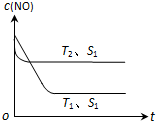
 �Ӻ�������ȡ���ʵ⼰��Ļ�������ת����ϵ��ͼ��ʾ��
�Ӻ�������ȡ���ʵ⼰��Ļ�������ת����ϵ��ͼ��ʾ��
 ����β���dz��е���Ҫ������Ⱦ��о���������β����Ϊ������������Ҫ����
����β���dz��е���Ҫ������Ⱦ��о���������β����Ϊ������������Ҫ���� ��
��